已知热化学方程式2SO2(g) + O2(g)  2 SO3(g) △H = -Q kJ/mol(Q>0),则下列说法
2 SO3(g) △H = -Q kJ/mol(Q>0),则下列说法
正确的是( ).
| A.2 mol SO2(g)和1 mol O2(g)所具有的内能小于2 mol SO3(g)所具有的内能 |
| B.将2 mol SO2(g)、1 mol O2(g)置于一密闭容器中充分反应后放出QkJ的热量 |
| C.升高温度,平衡向正反应方向移动,上述热化学方程式中的Q值减小 |
| D.如将一定量SO2(g)和O2(g)置于某密闭容器中充分反应后放热QkJ,则此过程中有2 mol SO2(g)被氧化 |
巴豆酸的结构简式为CH3—CH===CH—COOH,现有①氯化银'②溴水'③纯碱溶液'④2丁醇'⑤酸化的KMnO4溶液。试根据其结构特点判断在一定条件下能与巴豆酸反应的物质是( )
| A.只有②④⑤ | B.只有①③④ |
| C.只有①②③④ | D.只有②③④⑤ |
某有机物在酸性条件下水解生成X、Y两种有机物,X不能使紫色石蕊试液变色,Y能与小苏打反应产生无色气体。实验测得在同温同压下,相同质量的X、Y的蒸气所占的体积相同,则原有机物是( )
某有机物在一定条件下既可以氧化成羧酸,又可以还原成醇,该酸和该醇可生成分子式为C4H8O2的酯,则下列说法错误的是( )
| A.该有机物既有氧化性又有还原性 |
| B.该有机物能发生银镜反应 |
| C.将该有机物和分子式C4H8O2的酯组成混合物,只要总质量一定不论怎样调整二者的物质的量之比,完全燃烧时得到二氧化碳的量必定相等 |
| D.该有机物是乙酸的同系物 |
某一有机物A可发生下列变化: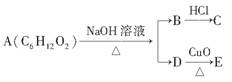
已知C为羧酸,且C、E不发生银镜反应,则A的可能结构有( )
A.4种 B.3种
C.2种D.1种
有机物①CH2OH(CHOH)4CHO ②CH3CH2CH2OH ③CH2===CH—CH2OH ④CH2===CH—COOCH3 ⑤CH2===CH—COOH中,既能发生加成反应、酯化反应,又能发生氧化反应的是( )
| A.③⑤ | B.②④ |
| C.①③⑤ | D.①③ |