25℃时,水的电离达到平衡:
H2O + H2O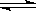 H3O+ + OH- ⊿H >0,
H3O+ + OH- ⊿H >0,
下列叙述正确的是 ( )
| A.向水中加入稀氨水,平衡逆向移动,C(OH-)降低 |
| B.向水中加入少量固体硫酸氢钠,C(H+)增大,KW不变 |
| C.向水中加入少量固体Na,平衡正向移动,C(OH-) 降低 |
| D.将水加热,KW增大,pH不变 |
迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构如下图。下列叙述正确的是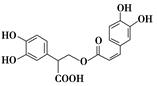
| A.迷迭香酸属于芳香烃 |
| B.1 mol迷迭香酸最多能和9 mol氢气发生加成反应 |
| C.迷迭香酸可以发生水解反应、取代反应和酯化反应 |
| D.1 mol迷迭香酸最多能和含5 mol NaOH的水溶液完全反应 |
某有机物分子中含n个—CH2—,m个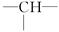 ,a个—CH3,其余为—OH。则—OH的个数为
,a个—CH3,其余为—OH。则—OH的个数为
| A.2n+3m-a | B.n+m+a | C.m+2-a | D.m+2n+2-a |
煤的气化是煤高效、洁净利用的方向之一。如图为加热某地煤样所得煤气组成及体积分数随温度变化的曲线图,由图可知该煤气中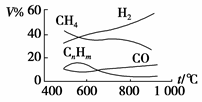
| A.只含有碳、氢两种元素 | B.所含的有机物是CH4、CnHm、CO |
| C.CO体积分数小于CH4体积分数 | D.氢气体积分数最大 |
有三种不同取代 基-X,-Y,-Z,当它们同时取代苯分子中的3个氢原子,取代产物有
基-X,-Y,-Z,当它们同时取代苯分子中的3个氢原子,取代产物有
| A.4种 | B.6种 | C.10种 | D.14种 |
有关系式:有机物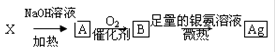 ,若该有机物X与析出的银的物质的量之比为1∶4,则该有机物X可能是
,若该有机物X与析出的银的物质的量之比为1∶4,则该有机物X可能是
| A.CH3Cl | B.CH3CH2Br | C.CH3CHBrCH3 | D.CH3CH2CH2Cl |