(Ⅰ)FeCl3的水溶液呈________(填“酸性”、“碱性”或“中性”),原因是__________________________________(用离子方程式表示);实验室配制FeCl3的水溶液时,常将FeCl3固体先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度,以___________(填“促进”、“抑制”)其水解;如果把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是____________________。
(Ⅱ)某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①用0.10mol/L的标准盐酸润洗酸式滴定管2~3次
②取标准盐酸注入酸式滴定管至“0”刻度以上2~3mL处
③把盛有标准盐酸的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液
④调节液面至“0”或“0”刻度以下,记下读数
⑤取20.00mL待测NaOH溶液注入洁净的锥形瓶中,并加入2~3滴甲基橙试液
⑥把锥形瓶放在滴定管的下面,用标准盐酸滴定至终点,记录滴定管读数
请回答下列问题:
(1)某次滴定时的滴定管中的液面如右图所示,其读数为 mL。
(2)根据下列数据:
| 滴定次数 |
待测液体积(mL) |
标准盐酸体积(mL) |
|
| 滴定前读数(mL) |
滴定后读数(mL) |
||
| 第一次 |
20.00 |
0.50 |
25.40 |
| 第二次 |
20.00 |
4.00 |
29.10 |
请计算待测烧碱溶液的浓度为 mol/L。
(3)下列实验操作会使实验结果偏高的是 。
A、锥形瓶用待测液润洗后再注入待测液
B、酸式滴定管未用标准液润洗,便装入标准液
C、酸式滴定管滴定前俯视读数,滴定后仰视读数
D、酸式滴定管滴定前有气泡,滴定后无气泡
喷泉是一种常见的自然现象,其产生的原因是存在压强差。制取氨气并完成喷泉实验(图中夹持装置均已略去)。
(1)写出实验室制取氨气的化学方程式:。
(2)收集氨气应使用法。
(3)要得到干燥的氨气可选用下列做干燥剂。
| A.浓硫酸 | B.碱石灰 | C.NaOH固体 | D.P2O5固体 |
(4)用图1装置进行喷泉实验,烧瓶已装满干燥氨气,引发水上喷的操作是。该实验的原理是。
(5)如果只提供如图2的装置,请举例说明引发喷泉法。
实验室需要配制2.0mol·L-1的NaCl溶液500 ml 。
(1) 本实验所必需的仪器有托盘天平(精确到0.1g)、药匙、烧杯、量筒、玻璃棒、胶头滴管、以及等质量的两片滤纸。
(2)某学生在摇匀后发现液面低于刻度线再加水,会导致结果(填“偏高”、“偏低”、“无影响”)。
某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。
(1)实验室用装置A制备SO2。某同学在实验时发现打开A的分液漏斗活塞后,漏斗液体未流下,你认为原因可能是
(2)实验室用装置E制备Cl2,其反应的化学化学方程式为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O请指出该反应中的液体反应物在反应中所表现出的化学性质:
MnCl2+Cl2↑+2H2O请指出该反应中的液体反应物在反应中所表现出的化学性质:
__________________________________________________________________;
(3)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:
B:________________________,D:____________________________。
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为
B:_________________________,D:____________________________。
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强,他们将制得的SO2和Cl 2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象那样。请你分析该现象的原因(用化学方程式表示)
2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象那样。请你分析该现象的原因(用化学方程式表示)
(1)下图为常见仪器的部分结构(有的仪器被放大)A图中液面所示溶液的体积为mL,用上述四种仪器中的某种测量一液体的体积,平视时读数为N mL,仰视时读数为M mL,若M>N,则所使用的仪器是____(填字母标号)。
(2)在化学分析中,常需用KMnO4标准溶液,由于KMnO4晶体在室温下不太稳定,因而很难直接配制准确物质的量浓度的KMnO4溶液。实验室一般先称取一定质量的KMnO4晶体,粗配成大致浓度的KMnO4溶液,再用性质稳定、相对分子质量较大的基准物质草酸钠[Mr(Na2C2O4)=134.0]对粗配的KMnO4溶液进行标定,测出所配制的KMnO4溶液的准确浓度,反应原理为:5C2O42-+2MnO4-+16H+→10CO2↑+2Mn2++8H2O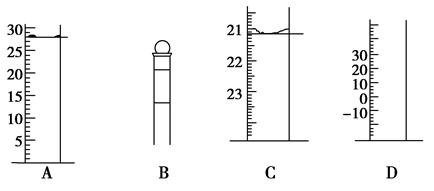
以下是标定KMnO4溶液的实验步骤:
步骤一:先粗配浓度约为0.15mol·L-1的高锰酸钾溶液500 mL。
步骤二:准确称取Na2C2O4固体m g放入锥形瓶中,用蒸馏水溶解并加稀硫酸酸化,加热至70~80℃,用步骤一所配高锰酸钾溶液进行滴定。记录相关数据。
步骤三:。
步骤四:计算得高锰酸钾的物质的量浓度。试回答下列问题:
①该滴定实验(“需要”或“不需要”)加指示剂。
②步骤二中滴定操作图示正确的是__________(填编号)。
③步骤二的滴定过程温度变化并不明显,但操作过程中发现前一阶段溶液褪色较慢,中间阶段褪色明显变快,最后阶段褪色又变慢。试根据影响化学反应速率的条件分析,溶液褪色明显变快的原因可能是_______,最后又变慢的原因是。④请写出步骤三的操作内容。⑤若m的平均数值为1.340g,滴定的KMnO4溶液平均用量为25.00mL,则KMnO4溶液的浓度为mol·L-1。
请回答有关下列五种气体:H2、O2、NO、NH3、NO2的问 题。
I.(1)与制取O2的发生装置相同的是;______________只能用一种方法收集的是______________________________
(2)以上气体制备反应中,有一反应在原理上与其它反应都不能归为同一类型,请写出实验室制取该气体的方程式_________________________________
II. 用右图装置进行喷泉实验(图中夹持装置均已略去)。
(1)若用图1装置进行喷泉实验,上部烧瓶已装满干燥的氨气,引发水上喷的操作是_____________________该实验的原理是______________________________________
(2)若用图2的装置,请举一例说明引发喷泉的方法___________________________
III:若用同一烧瓶分别充满如下气体:① HCl② NH3③ NO2进行喷泉实验,实验后烧瓶内溶液液面的高度关系为____________________________ (用序号和“>,<或=”表示,下同),所得溶液物质的量浓度大小关系为 ____________________________ 。