下图是元素周期表的一部分,针对表中的①~⑩中元素,填写下列空格:
| |
|
|
|||||||||||||||
| |
|
|
|
① |
⑩ |
② |
③ |
|
|||||||||
| |
④ |
⑤ |
|
|
⑦ |
⑧ |
⑨ |
||||||||||
| |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
⑥ |
|
|
| |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
⑴在这10种元素中,原子半径较小的是________(填元素符号),化学性质最不活泼的元素是_____(填“元素符号”);其中一种核素可测定文物年代,这种核素的符号是 。
⑵元素①的原子结构示意图为__________;元素①的最高价氧化物结构式为:________,
请用电子式表示化合物④和⑧的形成过程________________________________________________。
⑶元素⑤的单质与氢氧化钠溶液反应的化学方程式为:________________________________。
⑷元素⑤的单质与Fe和稀硫酸构成原电池,写出负极的电极反应为___________________________。
(5)元素⑧单质能溶于水,水液呈 色,在其中通入元素⑦的某种氧化物,溶液颜色褪去,用化学方程式表示原因 。
(6)在一定条件下,元素⑦与H2反应有一定限度(可理解为反应进行的程度),请判断在相同条件下元素⑥与H2反应的限度(选填“更大”、“更小”或“相同”) 。
请按要求写出:(1)过氧化钠与水反应的化学方程式:________________________。
(2)碳酸氢钠受热分解的化学方程式:________________________。
(3)Al与NaOH溶液反应的化学方程式:_________________________。
(4)用小苏打治疗胃酸过多的离子方程式:___________________________。
(5)在反应MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O(反应条件略去)中,氧化剂与还原剂的物质的量之比为________________________________。
已知A、B、C、D都是元素周期表中前36号的元素,它们的原子序数依次增大。A与其他3种元素既不在同一周期又不在同一主族。B原子的L层p轨道中有5个电子;C是周期表中1-18列中的第14列元素;D原子的L层电子数与最外层电子数之比为4:1,其d轨道中有一对成对电子。请回答:
(1)A与C形成的共价化合物的分子式是 ,中心原子杂化类型是__ ,分子的立体结构是 ,是 分子(填“极性”或“非极性”)
(2)B与C比较,电负性较小的是 (填元素符号);B与C形成的化合物晶体类型是 。
(3)D位于元素周期表中第 族,D2+的结构示意图是 ,它的+3价离子的电子排布式为 。
(4)A与B形成的化合物分子极易溶于水,其原因是 。
(5)由C原子构成的晶体中微粒间作用力是 ,右图是由C单质构成的晶体的一个晶胞,若设该晶胞的边长为a cm,NA表示阿伏加德罗常数,则该晶体的密度是 g/cm3.(只要求列出算式)。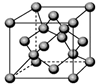
有A、B、C、D四种强电解质,它们在水中电离产生下列离子(每种物质只含一种阴离子且互不重复)。
| 阳离子 |
Na+、Ba2+、NH |
| 阴离子 |
CH3COO-、OH-、Cl-、SO |
已知:①A、C溶液的pH均大于7,A、B的溶液中水的电离程度相同;②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,A溶液和D溶液混合时无现象。
(1)A是______ ____,B是___ ___(填化学式) 。
用离子方程式表示A的水溶液中存在的平衡关系: 。
(2)写出C和D反应的离子方程式__________ _。
(3)25 ℃时,0.1 mol·L-1 B溶液的pH=a,则B溶液中:c(H+)-c(OH—)=_____ ____(填微粒浓度符号)=_____ ______(用含有a的关系式表示)。
(4)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序是 _。
(5)在一定体积的0.005 mol·L-1的C溶液中,加入一定体积的0.00125 mol·L-1的盐酸,混合溶液的pH=11,若反应后溶液的体积等于C溶液与盐酸的体积之和,则C溶液与盐酸的体积比是_ _____。
(6)现使用酸碱中和滴定法测定市售白醋的总酸量(g·100mL-1)。在本实验的滴定过程中,下列操作会使实验结果偏大的是__ (填写序号)。
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
(1)现有可逆反应.2NO2(g) N2O4(g),△H<0,试根据下列图象判断t2、t3、t4时采取的措施。
N2O4(g),△H<0,试根据下列图象判断t2、t3、t4时采取的措施。
t2: ;
t3: ;t4: 。
在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) C(mol/L) |
0 |
20 |
40 |
60 |
80 |
100 |
| C(N2O4) |
0.20 |
a |
0.10 |
c |
d[] |
e |
| C(NO2) |
0.00 |
0.12 |
b |
0.22 |
0.22 |
0.22 |
(2)40s时,NO2的产率是 。
(3)20s时,N2O4的浓度为 mol/L,0~20s内N2O4的平均反应速率为 。
(4)在80℃时该反应的平衡常数K值为 (保留2位小数)。
(5)在其他条件相同时,该反应的K值越大,表明建立平衡时 。
A、N2O4的转化率越高 B、NO2的产量越大
C、N2O4与NO2的浓度之比越大 D、正反应进行的程度越大
(6)利用甲烷催化还原NOx:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160 kJ/mol
则甲烷直接将NO2还原为N2的热化学方程式为:__ 。
某地煤矸石经预处理后含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)及少量钙镁的化合物等,一种综合利用工艺设计如下: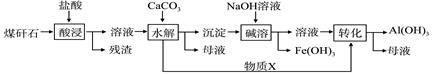
(1)“酸浸”过程中主要反应的离子方程式为:
、 _。
(2)“酸浸”时,提高浸出速率的具体措施有 __。(写出两个)
(3)“碱溶”的目的是_ ___。
物质X的电子式为_ 。该工艺设计中,过量X参与反应的离子方程式是: 。
(4)从流程中分离出来的Fe(OH)3沉淀可在碱性条件下用KClO溶液处理,制备新型水处理剂高铁酸钾(K2FeO4),该反应的离子方程式为:___ 。