将4molO2和3molNxHy(x<y<6)的混合气体在150℃和1.05×105 Pa下点燃,完全反应后,恢复到原来的温度与压强时,测得反应后N2、O2、H2O(g)的混合气体比原混合气体的密度减少3/10。
(1)此反应的化学方程式是(用NxHy表示)___________________________
(2)x与y的关系式为___________________________________________
(3)该分子中的两个氢原子被两个甲基取代后的产物之一N可以作为火箭的主要燃料,则N的同分异构体中含碳碳单键的化合物种类共有_________________种
(13分)四川北川盛产蔷薇科植物。蔷薇科植物中含有一种芳香醛(用E表示),在染料工业和食品工业上有着广泛的用途,下面是它的一种合成路线。


其中0.l mol有机物 A 的质量是 12g ,在足量的氧气中充分燃烧后生成0.8mol CO2和 7 . 2gH2O; D 能使溴的四氯化碳溶液褪色, D 分子与 C 分子具有相同的碳原子数; F 继续被氧化生成 G , G 的相对分子质量为 90 。
已知: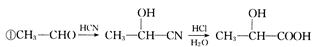


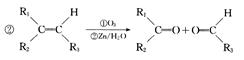
回答下列问题:
(l)A的结构简式为__________________。
(2)A~G中能发生酯化反应的有机物有:(填字母序号)
(3)C在浓硫酸加热的条件下时,分子内脱水除生成D外还可以生成另一种有机物,写出该反应的方程式:;该反应类型是
(4)C 的同分异构体有多种,其中符合下列要求的有机物有多种。
①能与3 mol NaOH溶液反应②苯环上的一卤代物只有一种
写出所有满足条件有机物的结构简式______________________________
(5)C与4-甲基-2,3-戊二醇两分子之间1:1发生取代反应,生成的有机物有种。
周期表中有X、Y、Z三种元素,已知:①X原子核外电子排布占有3个轨道,并且其第一电离能在同周期中按由大到小的顺序排列居第三位。②Y位于X的相邻周期,且Y最外层的p轨道有一个未成对电子。③Z与Y可组成化合物ZY3,ZY3溶液遇苯酚呈紫色。请回答:
(1)Z元素原子的价电子排布式为,其能与一些分子或离子形成配合物,[Z(CN)6]4-中离子CN-的电子式为。
(2)将ZY3溶液滴入沸水可得到红褐色液体,反应的离子方程式是此液体具有的性质是。
A.光束通过该液体时形成光亮的“通路”
B.插入电极通直流电后,有一极附近液体颜色加深
C.向该液体中加入硝酸银溶液,无沉淀生成
D.将该液体加热、蒸干、灼热后,有氧化物生成
(3)①常温下,将20mL 0.1mol·L—1Y的最高价氧化物对应水化物的水溶液与VmL 0.1mol·L—1 X气态氢化物的水溶液混合后pH=7,则V20mL(填“>”“<”或“=”)。
②常温下,将pH=2的Y的最高价氧化物对应水化物的水溶液V1mL与V2mL0.0lmol·L—1X气态氢化物的水溶液混合后,溶液呈酸性,则V1与V2的关系满足
A.V1>V2B.V1<V2C.V1=V2D.无法确定
此时溶液中离子浓度大小顺序可能为
A.c(YO4—)>c(XH4+)>c(H+)>c(OH—)
B.c(YO4—)>c(H+)>c(XH4+)>c(OH—)
C.c(YO4—)>c(XH4+)=c(H+)>c(OH—)
D.c(H+)>c(YO4—)>c(XH4+) >c(OH—)
(4)氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主反应①和副反应②
4NH3(g)+5O2(g) 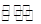 4NO(g)+6H2O(g);△H=-905kJ/mol①
4NO(g)+6H2O(g);△H=-905kJ/mol①
4NH3(g)+3O2(g)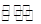 2N2(g)+6H2O(g);△H=-1268kJ/mol②
2N2(g)+6H2O(g);△H=-1268kJ/mol②
下列说法正确的是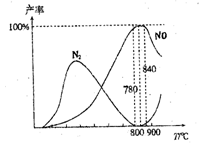
A.工业上进行氨催化氧化生成NO时,温度应控制在 7800C~8400C之间,且7800C时的平衡常数大于8400C时的平衡常数
B.工业上采用物料比n(O2)/n(NH3)在1.7~2.0之间,主要是为了提高反应速率
C.在加压条件下生产能力可提高5~6倍,主要是因为加压可提高原料的转化率
D.氮气氧化为NO的热化学方程式为:N2(g)+O2(g)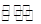 2NO(g); △H=-181.5kJ/mol
2NO(g); △H=-181.5kJ/mol
碳和氮的化合物与人类生产、生活密切相关。
(1)在一恒温、恒容密闭容器中发生反应:Ni (s)+4CO(g)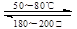 Ni(CO)4(g),ΔH<0。
Ni(CO)4(g),ΔH<0。
利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。下列说法正确的是(填字母编号)。
| A.增加Ni的量可提高CO的转化率,Ni的转化率降低 |
| B.缩小容器容积,平衡右移,ΔH减小 |
| C.反应达到平衡后,充入CO再次达到平衡时, CO的体积分数降低 |
| D.当4v正[Ni(CO)4]= v正(CO)时或容器中混合气体密度不变时,都可说明反应已达化学平衡状态 |
(2)CO与镍反应会造成含镍催化剂的中毒。为防止镍催化剂中毒,工业上常用SO2将CO氧化,二氧化硫转化为单质硫。
已知:CO (g)+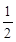 O2(g)=CO2(g)ΔH=-Q1 kJ·mol-1
O2(g)=CO2(g)ΔH=-Q1 kJ·mol-1
S(s)+O2(g)=SO2(g)ΔH=-Q2 kJ·mol-1
则SO2(g)+2CO (g)=S(s)+2CO2(g)ΔH=。
(3)对于反应:2NO(g)+O2 2NO2(g),向某容器中充入10mol的NO和10mol的O2,在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下随温度变化的曲线(如图)。
2NO2(g),向某容器中充入10mol的NO和10mol的O2,在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下随温度变化的曲线(如图)。
①比较P1、P2的大小关系:________________。
②700℃时,在压强为P2时,假设容器为1L,则在该条件平衡常数的数值为____(最简分数形式)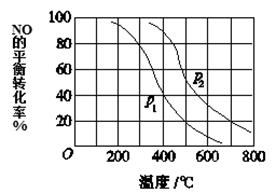
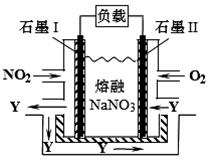
(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理如图所示。该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应式为。若该燃料电池使用一段时间后,共收集到20mol Y,则理论上需要消耗标准状况下氧气的体积为L。
亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它
在碱性环境中稳定存在。工业设计生产NaClO2的主要流程如图所示。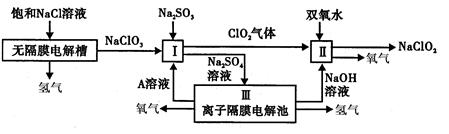
另附III离子交换膜电解池示意图。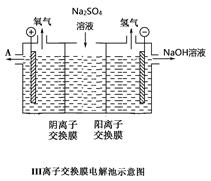
(1)写出无隔膜电解槽阳极反应的电极反应式:__________
(2)由离子交换膜电解池示意图分析A的化学式是__________
(3)Ⅱ中反应的离子方程式是__________
(4)设备Ⅲ在通电电解前,检验其溶液中主要阴离子的方法、步骤、现象是__________
(15分)下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
| 族 周期 |
IA |
0 |
||||||
| 1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 2 |
② |
③ |
④ |
|||||
| 3 |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
(1)画出元素⑦的原子结构示意图_________________________。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是____________(填化学式)
(3)①、④、⑤、⑨中的某些元素可形成既含离子键又含共价键的化合物,写出其中一种化合物的化学式:___________。
(4)写出元素③的气态氢化物与其最高价含氧酸的离子方程式_______________
写出元素②的单质与元素⑧最高价含氧酸浓溶液的反应化学反应方程式__________
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应: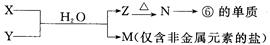
X溶液与Y溶液反应的离子方程式为_____________________________,