为保障人体健康,必须严格限制用量的是( )
| A.用SO2漂白食品 | B.用小苏打制作糕点 |
| C.用食醋清洗热水瓶胆内壁附着的水垢 | D.用O3对游泳池中的水进行消毒 |
将足量的铝粉分别加入下列100ml溶液中,充分反应后,放出氢气最多的是 ( )
| A.3mol·L-1 HCl | B.4mol·L-1 HNO3 |
| C.8mol·L-1NaOH | D.5mol·L-1 H2SO4 |
化学在生产和日常生活中有着重要的应用。下列说法不正确的是()
A.明矾水解形成的Al(OH)胶体能吸附水中悬浮物,可用于水的净化 |
B.家庭使用的“84”消毒液主要成分是NaClO |
C.MgO的熔点很高,可用于制作耐高温材料 |
D.电解MgCl2饱和溶液,可制得金属镁 |
无色的混合气体甲,可能含NO、CO2、NO2、NH3、N2中的几种,将100 mL甲气体经过下图所示实验的处理,结果得到酸性溶液,而几乎无气体剩余,则甲气体的组成为( )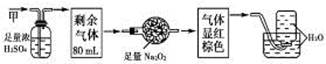
| A.NH3、NO2、O2 | B.NH3、NO、CO2 |
| C.NH3、NO2、CO2 | D.NO、CO2、N2 |
下列叙述正确的是 ( )
①海水中含有大量的Br-,所以从海水中提取溴一般要经历浓缩和提取两个步骤
②铝是一种比较活泼的金属,所以铝合金制品易被腐蚀
③在炼钢中加入适量的生石灰,可以除去其中的脉石
④制造玻璃的主要原料是纯碱、石灰石和石英
| A.②③ | B.②④ | C.③④ | D.①③ |
等物质的量的SO2和Cl2混合后,缓慢加入BaCl2溶液,再滴入品红试液,发生的现象是
| A.无沉淀生成,溶液显红色 | B.无沉淀生成,溶液显无色 |
| C.有沉淀生成,溶液显无色 | D.有沉淀生成,溶液显红色 |