合成氨厂所需H2可由焦炭与水反应制得,其中有一步反应为CO(g)+H2O(g)==CO2(g)+H2(g) △H<0欲提高CO转化率,可采用的方法是( )
①降低温度;②增大压强;③使用催化剂;④增大CO浓度;⑤增大水蒸气浓度
| A.①②③ | B.④⑤ | C.①⑤ | D.⑤ |
短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13。X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍,是Y原子最外层电子数的3倍。下列说法正确的是
| A.X的氢化物溶于水显酸性 | B.Y的氧化物是离子化合物 |
| C.Z的氢化物比H2O稳定 | D.X和Z的氧化物对应的水化物都是强酸 |
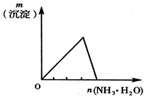
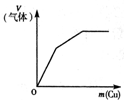
下列反应中,相关示意图像错误的是
| A |
B |
C |
D |
| 将二氧化硫通入到一定量氯水中 |
将氨水滴入到一定量氯化铝溶液中 |
将铜粉加入到一定量浓硝酸中 |
将铁粉加入到一定量氯化铁溶液中 |
 |
 |
 |
 |
用含少量镁粉的铝粉制取纯净的氢氧化铝,下述操作步骤中最恰当的组合是
①加盐酸溶解;②加烧碱溶液溶解;③过滤;④通入过量CO2生成Al(OH)3沉淀;⑤加入盐酸生成Al(OH)3、沉淀;⑥加入过量烧碱溶液。
| A.①⑥⑤③ | B.②③⑤③ | C.②③④③ | D.①③⑤③ |
在一定温度下的定容密闭容器中,当下列物理量不再改变时,表明反应:A(s)+2B(g)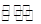 C(g)+D(g) 已达平衡的是
C(g)+D(g) 已达平衡的是
| A.混合气体的压强 | B.混合气体的密度 |
| C.B物质的相对分子质量 | D.气体的总物质的量 |
下列比值为2∶1的是
| A.pH=2与pH=1的硝酸中c(H+)之比 |
| B.Na2CO3溶液中c(Na+)与c(CO32ˉ )之比 |
| C.0.2mol/L与0.1mol/L醋酸中c(H+)之比 |
| D.NO2溶于水时,被氧化的n(NO2)与被还原的n(NO2)之比为 |