有关化学用语正确的是
| A.次氯酸的电子式:H ∶Cl∶O∶ | B.Mg2+的结构示意图: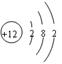 |
| C.氮气的结构式:∶N≡N∶ | D.氯化镁的电子式: |
用NA表示阿伏加德罗常数的值,下列说法中正确的是
| A.在常温常压下,11.2L Cl2含有的分子数为0.5NA |
| B.18克水所含的电子数为NA |
| C.8克氦气所含分子数为NA |
| D.3.2克氧气所含氧原子数为0.2NA |
实验室里需用490mL 0.1mol·L-1的硫酸铜溶液,现选取500mL容量瓶进行配制,以下操作正确的是
| A.称取7.84g硫酸铜配成500mL溶液 | B.称取12.25g胆矾配成500mL溶液 |
| C.称取12.5g胆矾配成500mL溶液 | D.称取8.0g硫酸铜,加入500mL水 |
据科学家预测,月球的土壤中吸附着数百万吨的3He,每百吨3He核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以4He的形式存在。下列说法中正确的是
| A.4He原子核内含有4个质子 | B.3He和4He互为同位素 |
| C.3He原子核内含有3个中子 | D.4He的最外层电子数为2,故 4He具有较强的金属性 |
已知最外层电子数相等的元素原子具有相似的化学性质。硫元素原子的核外电子分层排布示意图为,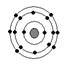 下列原子中,与硫元素原子化学性质相似的是
下列原子中,与硫元素原子化学性质相似的是
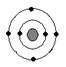
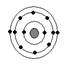

氖碳镁氧
A B C D
同温同压下,物质的量均为0.3mol的N2O(气)和NO2(气),它们的
| A.质量相同,体积不同 | B.体积相同,分子数不同 |
| C.分子数相同,质量相同 | D.体积相同,原子数相同 |