标准状况下,将NO2和NO组成的混合气体4.48L通入100mL水中,充分反应后,气体体积缩小为2.24L,假设溶液的体积不变,则下列说法中不正确的是
| A.所得溶液中溶质物质的量浓度为1.0 mol·L-1 |
| B.原混合气体中NO2和NO的体积比为1∶1 |
| C.反应过程中转移的电子总数为0.1mol |
| D.若将原混合气体和1.68 L(标准状况)O2混合后再通入100 mL水中,则充分反应后,不会有气体剩余 |
已知X、Y、Z、W为短周期主族元素,在周期表中的相对位置如图所示,下列说
法正确的是
| X |
Y |
| Z |
W |
A.若四种元素均为非金属,则W的最高价氧化物对应的水化物一定是强酸
B.若HmXOn为强酸,则X的氢化物溶于水一定显酸性(m、n均为正整数)
C.若四种元素均为金属,则Z的最高价氧化物对应的水化物一定为强碱
D.若四种元素中只有一种为金属,则Z与Y的最高价氧化物对应的水化物能反应
下列有关化学概念或原理的论述中,正确的是
| A.任何一个氧化还原反应都可以设计为电池,输出电能 |
| B.铅蓄电池放电时的负极和充电时的阴极均发生氧化反应 |
| C.电解饱和食盐水的过程中,水的电离平衡正向移动 |
| D.任何可逆反应,其平衡常数越大,反应速率、反应物的转化率就越大 |
下列离子方程式正确的是
| A.氨气通入醋酸溶液:CH3COOH+NH3=CH3COONH4 |
B.亚硫酸氢钠溶液呈酸性:HSO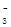 +H2O +H2O H3O++SO H3O++SO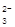 |
| C.氢氧化铁溶于氢碘酸中:Fe(OH)3+3H+=Fe3++3H2O |
D.稀硝酸洗涤试管内壁的银镜:Ag+2H++NO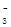 =Ag++NO↑+H2O =Ag++NO↑+H2O |
用下列装置进行相应实验,能达到实验目的的是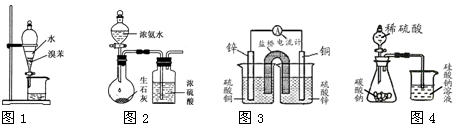
| A.用图1所示装置分离出溴苯 |
| B.用图2 所示装置制取干燥的氨气 |
| C.用图3设计成铜锌原电池装置 |
| D.用图4证明氢化物稳定性SiH4>CH4>H2S |
下列说法中,正确的是
| A.气象环境报告中新增的“PM2.5”是对一种新分子的描述 |
| B.“光化学烟雾”“硝酸型酸雨”的形成都与氮氧化合物有关 |
| C.小苏打是制作面包等糕点的膨松剂,苏打是治疗胃酸过多的一种药剂 |
| D.乙醇、过氧化氢、次氯酸钠等消毒液均可以将病毒氧化而达到消毒的目的 |