下图是一些常见单质、化合物之间的转化关系图。有些反应中的部分物质及反应条件被略去。A和B组成元素相同,在常温下都是无色液体。D和E的组成元素相同,且E为红棕色的气体。I和K的组成元素相同,I在常温下是无色有毒气体,
J是红棕色固体,G是目前用量最多、用途最广的金属单质。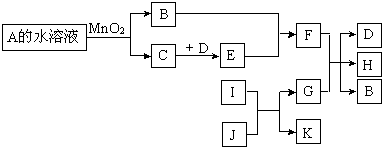
(1)A的化学式是 。
(2)K的电子式是 。
(3)请写出E和B反应的化学方程式 。
(4)请写出G和足量的F稀溶液反应的离子方程式 。
(5)常温下G (填“能”或“不能”)溶解于浓的F溶液中,原因是 。
已知几种难溶电解质的溶度积如下表所示:
| 几种难溶电解质的Ksp(25℃) |
|
| 沉淀溶解平衡 |
Ksp |
 AgBr(s) Ag+(aq)+Br-(aq) AgBr(s) Ag+(aq)+Br-(aq) |
5,0×10-13mol2·L-2 |
 AgI(s)Ag+(aq)+I-(aq) AgI(s)Ag+(aq)+I-(aq) |
8.3×10-17mol2·L-2 |
 FeS(s) Fe2+(aq)+S2-(aq) FeS(s) Fe2+(aq)+S2-(aq) |
6.3×10-18mol2·L-2 |
 ZnS(s) Zn2+(aq)+S2-(aq) ZnS(s) Zn2+(aq)+S2-(aq) |
1.6×10-24mol2·L-2 |
 CuS(s) Cu2+(aq)+S2-(aq) CuS(s) Cu2+(aq)+S2-(aq) |
1.3×10-36mol2·L-2 |
(1)AgBr、AgI、FeS、ZnS、CuS的溶解能力由大到小的顺序为:。
(2)向饱和的AgI溶液中加入固体硝酸银,则[I-](填“增大”、“减小”或“不变”),若改加AgBr固体,则[Ag+](填“增大”、“减小”或“不变”)。
(3)在25℃时,向100mL浓度均为0.1 mol·L-1 FeCl2、ZnCl2、CuCl2的混合溶液中逐滴加入Na2S溶液,生成的沉淀的先后顺序是(用沉淀物的化学式表示)。
(4)在25℃时,把ZnS加入蒸馏水中,一定时间后达到如下平衡:
ZnS(s)  Zn2+(aq)+S2-(aq),下列措施可使ZnS减少的是()
Zn2+(aq)+S2-(aq),下列措施可使ZnS减少的是()
| A.加入少量CuS固体 | B.加入少量FeS固体 |
| C.加入少量FeCl2固体 | D.加入少量CuCl2固体 |
恒温、恒压下,在一可变容器下反应,A(g) + B(g) C(g)
C(g)
(1) 开始时,放入1 mol A和1 mol B,达到平衡后,生成a mol C,这时A的物质的量为____mol
(2) 若开始时放入3 mol A、3 mol B,到达平衡后生成C的物质的量为___ mol
(3) 若开始时,放入 X mol A、2 mol B和1 mol C,到达平衡后,A和C的物质的量分别是Y mol 和3a mol ,则X==_____,Y=_____
(4) 若在(3)的平衡状态上再加入3 mol C,待再次平衡后,C的物质的量分数是
明矾可做净水剂是因为,有关的离子方程式为 ;向明矾的水溶液中加入饱和的小苏打溶液,则观察到的现象是,有关的离子方程式。
已知:H2O(g)=H2O(l);△H2=-44.0kJ/mol,将0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,该反应的热化学方程式_。则11.2L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是_____________kJ。
医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2·2H2O的质量分数为97.0%~103.0%)的主要流程如下: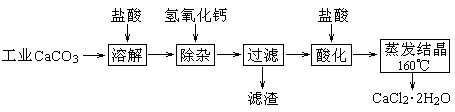
(1)除杂操作是加入Ca(OH)2,调节溶液pH为8.0~8.5,以除去溶液中的少量Al3+、Fe3+。检验Fe(OH)3是否沉淀完全的实验操作是。
(2)酸化操作是加入盐酸,调节溶液的pH约为4.0,其目的有:①防止Ca2+在蒸发时水解;②。
(3 )测定样品中Cl-含量的方法是:a.称取0.7500 g样品,溶解,在250 mL容量瓶中定容;b.量取25.00 mL待测溶液于锥形瓶中;c.用0.05000 mol·L-1 AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.39 mL。
)测定样品中Cl-含量的方法是:a.称取0.7500 g样品,溶解,在250 mL容量瓶中定容;b.量取25.00 mL待测溶液于锥形瓶中;c.用0.05000 mol·L-1 AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.39 mL。
①上述测定过程中需用溶液润洗的仪器有。 ②计算上述样品中CaCl2·2H2O的质量分数为。
③若用上述方法测定的样品中CaCl2·2H2O的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有;。