有关常温下pH均为3的醋酸和硫酸的说法正确的是
| A.两种溶液中,由水电离出的氢离子浓度均为1×10-11mol·L-1 |
| B.分别加水稀释100倍后,两种溶液的pH仍相同 |
| C.醋酸中的c(CH3COO-)和硫酸中的c(SO42-)相等 |
| D.分别加入足量锌片,两种溶液生成H2的体积相同 |
一定能在下列溶液中大量共存的离子组是
| A.水电离产生的H+浓度为1×10-12mol·L-1的溶液:NH4+、Na+、C1-、HCO3- |
| B.含有大量Fe3+的溶液:SCN-、I-、K+、Br- |
| C.能使pH试纸变蓝色的溶液:Na+、S2-、CO32-、AlO2- |
| D.澄清透明的无色溶液:CIO-、MnO4-、A13+、SO42- |
室温下,0.1mol·L-1的NaHB溶液中c(H+)>c(OH-)。则下列关系中一定正确的是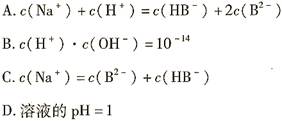
下列各溶液中,微粒的物质的量浓度关系正确的是
A.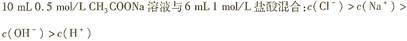 |
B.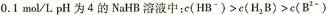 |
C.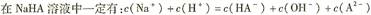 |
D.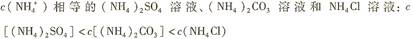 |
某浓度的氨水中存在下列平衡: ,如想增大
,如想增大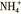 的浓度,而不增大
的浓度,而不增大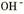 的浓度,下列措施不正确的是
的浓度,下列措施不正确的是
| A.适当升高温度 | B.加入NH4Cl固体 |
| C.加少量MgC12 | D.加入少量盐酸 |