以苯酚为原料的合成路线如下所示,请按要求作答: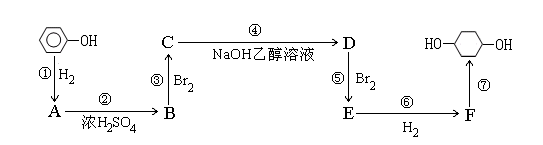
(1)写出以下物质的结构简式:
B: ; F: ;
(2)写出反应①④的化学反应方程式:
①
④
(3)反应⑤可以制得E,同时可能得到的副产物的结构简式为:
颠茄酸酯(J)是一种溃疡病治疗的辅助药物,其合成路线如下:
试回答下列问题:
(1)烃B其相对分子质量小于118,分子中氢的质量分数为7.69% ,且反应1为加成反应,则X的名称为________。B含有的官能团是____________。
(2)G→H 的反应类型为____________。
(3)C的结构简式为__________。
(4)反应3的化学方程式为_________________。
(5)化合物I有多种同分异构体,同时满足下列条件的结构有_______种。
①能发生水解反应和银镜反应;②能与FeC13发生显色反应;③苯环上有四个取代基,且苯环上一卤代物只有一种
(6)参照颠茄酸酯的合成路线,设计一条以 为起始原料制备
为起始原料制备 的合成路线___________________________________________。
的合成路线___________________________________________。
(1)电子工业中使用的一氧化碳常以甲醇为原料通过脱氢、分解两步反应得到。
第一步:2CH3OH(g)  HCOOCH3(g)+2H2(g)△H>O
HCOOCH3(g)+2H2(g)△H>O
第二步:HCOOCH3(g)  CH3OH(g)+CO(g)△H>O
CH3OH(g)+CO(g)△H>O
第一步反应的机理可以用图1表示,中间产物X的结构简式为___________。

(2)为进行相关研究,用CO还原高铝铁矿石,反应后固体物质的X-射线衍射谱图如图2所示(X-射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。反应后混合物中的一种产物能与盐酸反应生产两种盐,该反应的离子方程式为:_____________。
(3)某催化剂样品(含Ni2O340%,其余为SiO2)通过还原、提纯两步获得镍单质:首先用CO将33.2g样品在加热条件下还原为粗镍;然后在常温下使粗镍中的Ni与CO结合成Ni(CO)4、(沸点43℃),并在180℃时使Ni(CO)4重新分解产生镍单质。上述两步中消耗CO的物质的量之比为______________。
(4)为安全起见,工业生产中需对空气中的CO进行监测。使用电化学一氧化碳气体传感器定量检测空气中CO含量,其结构如图3 所示。这种传感器利用原电池原理,则该电池的负极反应式为:_____________________。
用惰性电极电解200mL一定浓度的硫酸铜溶液,实验装置如图①所示,电解过程中的实验数据如图②所示,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况)。
(1)电解过程中,a电极表面的现象是___________________________________;
(2)a电极上发生的反应为________________________________________________;
(3)从P点到Q点时收集到的混合气体的平均摩尔质量为___________ g·mol-1;
(4)如果要使溶液恢复到电解前的状态,向溶液中加入0.8 g CuO即可,则电解后溶液的pH为______;
(5)如果向所得的溶液中加入0.1 mol Cu2(OH)2CO3后,使溶液恰好恢复到电解前的浓度和pH(不考虑CO2的溶解),电解过程中转移的电子为______mol。
根据信息作答:
(1)在精制饱和食盐水中加入碳酸氢铵可制备小苏打(NaHCO3),并提取氯化铵作为肥料或进一步提纯为工业氯化铵。
①写出上述制备小苏打的化学方程式:__________________________________。
②滤出小苏打后,母液提取氯化铵有两种方法:Ⅰ.通入氨,冷却、加食盐,过滤;Ⅱ.不通氨,冷却、加食盐,过滤。其中方法Ⅰ析出的氯化铵的纯度更高,其原因是___________。而方法Ⅱ的优点是其滤液可以_______________。
(2)铅及其化合物可用于蓄电池,耐酸设备及X射线防护材料等。PbO2可由PbO与次氯酸钠溶液反应制得,反应的离子方程式为_____________________:PbO2也可以通过石墨为电极,Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生的电极反应式_________________,电解液中加入Cu(NO3)2的原因是___________________。
工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量FeO、CuO等氧化物杂质)制取金属锌的流程如图所示。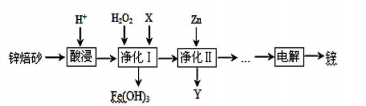
(1)提高酸浸效率的措施为____________(任答一条即可);酸浸时H+与难溶固体ZnFe2O4反应的离子方程式为____________________________。
(2)净化I中H2O2参与反应的离子方程式为_____________________;X可选择的试剂为___________(写化学式),净化II中Y为__________(写化学式);
(3)电解法制备锌的装置如图甲所示: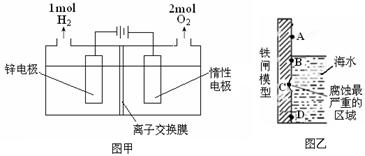
则电解槽中盛有的电解质溶液为__________(填字母);
a.ZnCl2溶液 b.Zn(NO3)2溶液 c.ZnSO4溶液
(4)使用含有[Zn(OH)4]2-的强碱性电镀液进行镀锌防腐蚀,可得到细致的光滑镀层,电镀时阴极电极反应式_______________。以锌为负极,采用牺牲阳极法防止铁闸的腐蚀,图乙中锌块的固定位置最好应在_________处(填字母)。