下列电离方程式正确的是
| A.NaHCO3(溶液):NaHCO3=Na++H++CO32- |
| B.NaHSO4(熔融):NaHSO4=Na++H++SO42- |
| C.(NH4)2SO4(溶液):(NH4)2SO4=(NH4)2++SO42- |
D.NH3·H2O(溶液):NH3·H2O NH4++OH- NH4++OH- |
与氢氧根具有相同质子数和电子数的微粒是()
| A.F— | B.Cl— | C.NH3 | D.NH4+ |
下面互为同素异形体的一组是()
| A.红磷和白磷 | B.甲烷和乙烷 | C. 和 和 |
D.K和K+ |
“可燃冰”又称“天然气水合物”,它是在海底生成,外观象冰。1体积“可燃冰”可贮载100~200体积的天然气。下面关于“可燃冰”的叙述不正确的是( )
| A.“可燃冰”有可能成为人类未来的重要能源 | B.“可燃冰”是一种比较洁净的能源 |
| C.“可燃冰”提供了水可能变成油的例证 | D.“可燃冰”的主要可燃成份是甲烷 |
高纯氧化铝可用于制高压钠灯的陶瓷管。实验室制取高纯氧化铝的流程如下: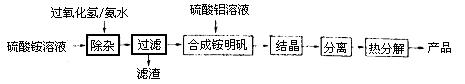
(1)“除杂”操作是加入适量过氧化氢,用氨水调节溶液的pH约为8.0,以除去硫酸铵溶液中的少量Fe2+。检验Fe2+是否除尽的实验操作是。
(2)通常条件下,KSP[Fe(OH)3]=4.0×10-36,除杂后溶液中c(Fe3+)=。
(3)配制硫酸铝溶液时,需用硫酸酸化,酸化的是目的是。
(4)“结晶”操作中,母液经蒸发浓缩至溶液表面刚出现薄层的结晶为止,冷却结晶,得到铵明矾(含结晶水)。母液不能蒸干的原因是。
(5)“分离”操作名称是(填字母代号)
A.蒸馏 B.分液 C.过滤W ww.k s5u.co m
(6)测定铵明矾组成的方法是:
a.称取0.906g铵明矾样品,高温灼烧,得Al2O3残留固体0.1020g;
b. 称取0.4530g铵明矾样品,用适量蒸馏水溶解,再加入稍过量的BaCl2溶液,经陈化、过滤、灰化,得BaSO40.4659g;
c. 称取0.4530g样品,加入足量的NaOH溶液,加热,产生气体依次通过碱石灰和浓硫酸,浓硫酸增重0.0170g。
则铵明矾的化学式为。
现有a mol/L NaX和bmol/L NaY两种盐溶液。下列说法正确的是()
| A.若a=b且c(X-)=c(Y-)+c(HY),则酸性HX>HY |
| B.若a>b且c(X-)=c(Y-),则酸性HX<HY |
| C.若a=b且pH(NaX)>pH(NaY),则酸性HX>HY |
| D.若两溶液等体积混合,测得c(X-)+c(Y-)+c(HX)=0.1mol/L,则a=b=0.1mol/L, |