下列措施或事实能用勒沙特列原理解释的是
| A.在合成氨(正反应是放热)的反应中,升温有利于氨的合成 |
| B.钢铁在潮湿的空气中生锈 |
| C.H2、I2、HI平衡混合气加压后颜色变深 |
| D.新制的氯水在光照下颜色变浅 |
下列关于热化学反应的描述中正确的是
| A.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的ΔH=+2×283.0kJ/mol |
| B.HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57. 3)kJ/mol |
| C.需要加热才能发生的反应一定是吸热反应 |
| D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
某同学在实验报告中记录下列数据,其中正确的是
| A.用25 mL量筒量取12.36 mL盐酸 |
| B.用托盘天平称取8.75克食盐 |
| C.用电子天平称取1.2355克无水碳酸钠 |
| D.用广泛pH试纸测得某溶液pH为3.5 |
一定温度下,把2. 0体积的N2和6. 0体积的H2通入一个带活塞的体积可变的容器中,活塞的一端与大气相通,容器中发生如下反应:N2+3H2
 2NH3。已知平衡时NH3的浓度是c mol·L-1,现按下列四种配比作为起始物质,分别充入上述容器,并保持温度不变,则达到平衡后,NH3的浓度不为c mol·L-1的是
2NH3。已知平衡时NH3的浓度是c mol·L-1,现按下列四种配比作为起始物质,分别充入上述容器,并保持温度不变,则达到平衡后,NH3的浓度不为c mol·L-1的是
| A.1.0体积的N2和3.0体积的H2 |
| B.2.0体积的N2、6.0体积的H2和4.0体积的NH3 |
| C.4.0体积的NH3和1.0体积的H2 |
| D.2.0体积的NH3 |
某学生欲完成2HCl+2Ag=2AgCl↓+H2↑反应,设计了下列四个实验,你认为可行的是
某反应:A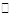 B + C 在室温下不能自发进行,在高温下能自发进行,对该反应过程△H、△S的判断正确的是
B + C 在室温下不能自发进行,在高温下能自发进行,对该反应过程△H、△S的判断正确的是
| A.△H>0、△S>0 | B.△H>0、△S<0 |
| C.△H<0、△S>0 | D.△H<0、△S<0 |