高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为: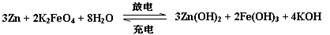 ,下列叙述错误的是:
,下列叙述错误的是:
| A.放电时正极附近溶液的碱性增强 | B.放电时每转移3 mol电子,正极有1mol K2FeO4被还原 |
| C.充电时锌极与外电源负极相连 | D.充电时阳极反应为:Fe(OH)3— 3e-+ H2O |
人们的生活、生产与化学息息相关,下列说法不正确的是( )
| A.在即将到来的新能源时代,核能、太阳能、氢能将成为主要能源 |
| B.地沟油经过处理后可作为汽车燃油,故地沟油主要成分是液态烃 |
| C.实施化石燃科脱硫,脱硝可以减少硫的氧化物和氮的氧化物的排放 |
| D.雾霾天气中的主要污染物是PM2.5,其中含氮的有机物和光发生化学作用,可形成光化学烟雾 |
常温下,向20.00 mL 0.1000 mol·L-1CH3COONa溶液中逐滴加入0.1000 mol·L-1盐酸,混合溶液的pH与所加盐酸体积的关系如图所示。下列说法正确的是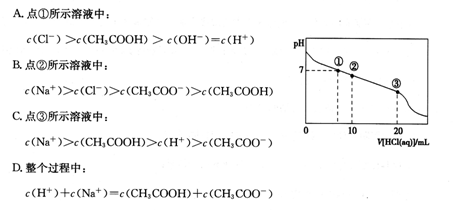
某电化学实验装置如图所示,下列说法正确的是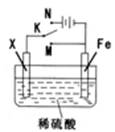
| A.若X为碳棒,开关K置于M处,则溶液中的H+移向Fe极 |
| B.若X为碳棒,开关K置于N处,转移0.2mole一时析出0.lmolO2 |
| C.若X为铜棒,开关K置于M或N处,均可减缓铁的腐蚀 |
| D.若X为锌棒,开关K置于M或N处,锌电极上反应均为Zn-2e一=Zn2+ |
-定条件下,在体积为VL的密闭容器中发生如下反应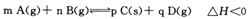 一段时间后达到化学平衡状态。改变某一条件,下列说法正确的是
一段时间后达到化学平衡状态。改变某一条件,下列说法正确的是
| A.若升高温度,反应混合气体密度不变时即达到新平衡状态 |
| B.若增大B的浓度,△H减小 |
| C.若使用适当催化剂,A的转化率增大 |
| D.若增大压强,平衡向右移动,则m+n>p+q |
下列现象或事实可用同一原理解释的是
A氯化铵晶体和碘晶体加热都产生气体
B.明矾和液氯都可用于处理生活用水
C.漂白粉和过氧化钠都可用于漂白有色织
D.常温下,铁和铜分别放在浓硫酸中都无明显现象