下列描述中,前者一定大于后者的
| A.22.4LCO2与11.2LCO气体所含的分子数; |
| B.放热反应中,反应物的总能量与生成物的总能量; |
| C.0.2mol/LNaOH与0.1mol/LNa2CO3溶液中Na+的物质的量浓度; |
| D.1mol水分子与1mol铵根离子中含有的电子数; |
现有①溴水②烧碱溶液③纯碱溶液④小苏打溶液⑤2-丁醇⑥酸性高锰酸钾溶液,其中能和乙酸反应的是
| A.①②③④⑤ | B.②③④⑤ | C.②③④ | D.①②③④⑤⑥ |
已知A、B、C、D、E是核电荷数依次增大的五种短周期元素,原子半径按D、E、B、C、A的顺序依次减小,B和E同主族。下列推断不正确的是()
A.A、B、E一定在不同周期
B.C的最高价氧化物的水化物可能显碱性
C.A、D可能在同一主族
D.C和D的单质可能化合形成离子化合物
下列关于羟基和氢氧根的说法中,不正确的是()。
| A.羟基比氢氧根少一个电子 |
| B.两者的组成元素相同 |
| C.羟基不带电,氢氧根带一个单位负电荷 |
| D.羟基比氢氧根性质稳定 |
A、B、C 三种醇同足量的金属钠反应,在相同条件下产生相同体积的氢气,消耗这三种醇的物质的量之比为3:6:2,则 A、B、C 三种醇分子中羟基数之比是
A. 3:2:1 B. 2:6:3 C. 3:6:2D. 2:1:3
化学家们合成了一种新物质——五星烷,其键线式如图所示(已知:CH2CHCH2CHO的键线式为: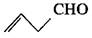 )。下列有关五星烷的说法正确的是 ( )
)。下列有关五星烷的说法正确的是 ( )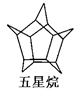
| A.五星烷与乙烷互为同系物 |
| B.五星烷的化学式为C15H20 |
| C.五星烷分子中含有7个五元环 |
| D.五星烷的一氯代物有三种 |