氢气是工业上重要的原料。
(1)氢气用于工业合成氨 N2(g) + 3H2(g)  2NH3(g);ΔH =" -92.2" kJ·mol-1。
2NH3(g);ΔH =" -92.2" kJ·mol-1。
①一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如下图所示,其中t2 ﹑t4 ﹑t5﹑t7时刻所对应的实验条件改变分别是
t2 t4 t5 t7 。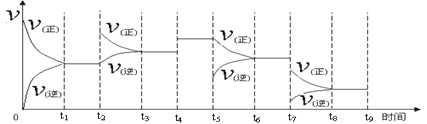
②温度为T℃时,将2amolH2和amolN2放入0.5L密闭容器中,充分反应后测得N2的转化率为50﹪,此时放出热量46.1 kJ。则该温度下反应的平衡常数为 。
(2)在容积相同的两密闭容器A和B中,保持温度为423K,同时向A、B中分别加入1mol及2mol碘化氢待反应:2HI(g) H2(g)+I2(g) 达到平衡后,平衡时I2的浓度c(I2)A c(I2)B ;平衡时HI的分解率αA αB ;平衡时H2在混合气体中的体积分数A B (填写“>”“<”“=”)
H2(g)+I2(g) 达到平衡后,平衡时I2的浓度c(I2)A c(I2)B ;平衡时HI的分解率αA αB ;平衡时H2在混合气体中的体积分数A B (填写“>”“<”“=”)
X、Y、Z、W、T是元素周期表中前四周期的五种元素。有关这五种元素的信息如下表:
| 元素代号 |
相关信息 |
| X |
它的一种核素的原子核内没有中子 |
| Y |
能组成很多种性质不同的单质,也是形成化合物种类最多的一种元素 |
| Z |
基态原子的最外层电子排布式为nsnnpn+1 |
| W |
与钠元素能组成两种化合物,这些化合物与水反应均生成碱;大气平流层中W3被誉为地球生物“保护伞” |
| T |
主要化合价有+1和+2价,其二价离子在水溶液中呈蓝色 |
请推出具体元素,用化学用语回答下列问题:
(1)写出W元素在周期表中的位置____________。写出T元素的基态电子排布式________________。
(2)在这五种元素中电负性最大的是________,Y Z W三种元素的第一电离能顺序为_______________。
(3)由X Z 两种元素可以形成一种ZX5的既含离子键又含共价键的化合物,其电子式为__________。
(4)TW在高温条件下是一种优良的氧化剂,它能将很多有机化合物完全氧化(相当于完全燃烧),写出高温条件下,TW与Y最简单的氢化物反应的化学方程式:_______________________________________。
(5)已知在25℃、101 kPa下:
XYZ(aq)+X2W(1)  YZ- (aq)+X3W+(aq) ΔH="+45.6" KJ/mol
YZ- (aq)+X3W+(aq) ΔH="+45.6" KJ/mol
X3W+(aq)+WX(aq)=2X2W(1) ΔH="-57.3" KJ/mol
则在25℃、101 kPa的稀溶液中,XYZ与WX反应的热化学方程式(以离子方程式表示) :_________。
由美国通用原子能公司(GA)提出的碘硫循环被公认为是效率最高(预期转化率可达50%以上)、最有希望实现的热化学分解物质X的循环。其流程如下: 
(1)物质X是_____________(填化学式);在此循环过程中,有一种物质,当作为反应物时只是还原剂,作为生成物时是还原产物,该化合物是__________。
(2)在实验室中进行蒸馏操作时,所需的玻璃仪器为蒸馏烧瓶、温度计、尾接管、锥形瓶、____________。
(3)氧缺位铁酸铜(CuFe2O4-x)可作上述流程中硫酸分解的催化剂。先在一定条件下,向Fe( NO3)3和Cu(NO3)2混合液中加入KOH,制得铁酸铜( CuFe2O4),此反应的化学方程式为:____________;然后在______(填一常见气体)保护下,高温煅烧2h得到CuFe2O3.86,试计算1 mol CuFe2O3.86中Fe2+的物质的量为____mol。
(4)硫酸分解随温度等变化规律的实验结果如图所示,表示没有使用催化剂的曲线是______(填图中数字)。
用邻二氯苯、邻位香兰醛为原料可制取盐酸黄连素,可由下列路线合成:
(1)邻位香兰醛的官能团有:醚键、______________________________。
(2)写出邻二氯苯转化为A的化学反应方程式 ____________________________。
(3)A→B化学反应类型是_____________________________ 。
(4)下列关于C的说法正确的是_____。
| A.1molC最多能和3mol氢气反应 |
| B.能与盐酸反应生成盐 |
| C.分子式是C9H10NO2 |
| D.易发生水解反应 |
(5)C的一种同分异构体是人体必需的氨基酸,试写出该氨基酸的结构简式___________。写出符合以下条件的D的同分异构体结构简式______________________________。
①能与Fe3+显色反应
②能发生银镜反应和水解反应
③苯环上一氯取代物只有1种
X、Y、Z、W是元素周期表前四周期中常见的元素,其相关信息见下表:
| 元素 |
相关信息 |
| X |
X的基态原子核外的三个能级上电子数相等 |
| Y |
Y与X同周期,Y基态原子p能级的成对电子数与未成对电子数相等 |
| Z |
Z的单质是一种银白色活泼金属,在空气中燃烧后生成淡黄色的固体 |
| W |
向含W2+的溶液中滴加强碱,其白色氢氧化物在空气中迅速变成灰绿色,最后变成红褐色 |
(1)W位于周期表的第______周期_____族,其基态原子最外层有________个电子。
(2)X的最简单氯化物分子呈____________型结构, Z在空气中燃烧生成的淡黄色的固体中含有的化学键类型____________________。
(3)若将金属Z投入含WCl3的溶液中,发生反应的离子方程式为____________________。
(4)工业上冶炼W过程涉及以下两个热化学方程式:
3W2Y3(s)+XY(g) =2W3Y4(s)+XY2(g)△H=-15.73kJ/mol
W3Y4(s)+XY (g) =" 3WY" (s)+XY 2(g)△H= +640.4kJ/mol
则反应W2Y3 (s)+XY (g) =" 2" WY (s)+XY 2(g) 的△H= _________________。
硫酸亚锡(SnSO4)是一种重要的能溶于水的硫酸盐,广泛应用于镀锡工业。某研究小组
设计SnSO4制备路线如下:
查阅资料:
I.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnC12易水解生成碱式氯化亚锡[Sn(OH)Cl]
回答下列问题:
(1)操作l的步骤为 ____、____、过滤、洗涤、干燥。对沉淀进行洗涤的方法是_____________。
(2) SnCl2粉末需加浓盐酸进行溶解,请结合必要的化学方程式用平衡移动原理解释原因:________。
(3)加入Sn粉的作用有两个:①调节溶液pH;②__________。
(4)酸性条件下,SnSO4还可以用作双氧水去除剂,发生反应的离子方程式是:________________。
(5)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):取ag锡粉溶于盐酸中,向生成的SnC12中加入过量的FeC13溶液,用b mol/LK2Cr2O7滴定生成的Fe2+(已知酸性环境下,Cr2O72-可被还原为Cr3+),共用去K2Cr2O7溶液m ml。则锡粉中锡的质量分数是________。(Sn的摩尔质量为M g/mol,用含a、b、m、M的代数式表示)