某种氢氧燃料电池的电解液为KOH溶液。下列有关电池的叙述不正确的是
| A.负极反应式为:H2+2OH-—2e-==H2O |
| B.工作一段时间后,电解液中的KOH的物质的量不变 |
| C.该燃料电池的总反应方程式为:2H2+O2==2H2O |
| D.用该电池电解CuCl2溶液,产生2.24LCl2(标准状况)时,有0.1mol电子转移 |
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是()
3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是()
| A.放电时锌作负极 |
| B.充电时氢氧化铁被氧化 |
| C.放电时溶液的碱性增强 |
| D.放电时转移3 mol e-,有2 mol FeO42-被还原 |
下图为一种新型的生物燃料电池,它有两个涂覆着酶的电极,处于充满空气和少量氢气的玻璃槽中,由于气体可以混合从而省去了昂贵的燃料隔离膜。下列对其工作原理叙述正确的是()
| A.该电池工作过程中,H+浓度不断增大 |
| B.该电池在高温环境下能提供更好的动力 |
| C.该电池负极反应为:H2-2e-=2H+ |
| D.该电池正极反应为:O2+4e-=2O2- |
化学平衡常数(K)、电离常数(Ka)、溶度积常数(Ksp)是判断物质性质或变化的重要的常数。下列关于这些常数的说法中,正确的是( )
| A.化学平衡常数的大小与温度、浓度、压强、催化剂有关 |
| B.CH3COONH4溶液几乎呈中性,说明Ka(CH3COOH)与Kb(NH3·H2O)近似相等 |
| C.Ksp(AgCl)>Ksp(AgI),由此可以判断AgCl(s)+I-=AgI(s)+Cl-能够发生 |
| D.Ka(HCN)<Ka(CH3COOH),说明相同浓度时,氢氰酸的酸性比醋酸强 |
室温下,在25 mL 0.1 mol/L NaOH溶液中逐滴加入0.2 mol/L CH3COOH溶液,pH与滴加CH3COOH溶液体积的关系曲线如图所示,若忽略两溶液混合时的体积变化,下列有关粒子浓度关系的说法错误的是( )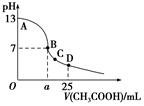
A.在A、B间任一点,溶液中一定都有c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
B.在B点:a>12.5,且有c(Na+)=c(CH3COO-)>c(OH-)=c(H+)
C.在C点:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D.在D点:c(CH3COO-)+c(CH3COOH)=0.1 mol/L
下列溶液中微粒的物质的量浓度关系一定正确的是( )
| A.0.2 mol/L CH3COONa溶液和0.1 mol/L HCl溶液等体积混合后:c(CH3COO-)>c(Na+)>c(Cl-)>c(H+)>c(OH-) |
| B.pH=3的盐酸和NaNO3的混合溶液中:c(Na+)=c(Cl-) |
| C.0.1 mol/L NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) |
| D.物质的量浓度相等的HCN(弱酸)和NaCN溶液等体积混合后有:c(HCN)+2c(H+)=2c(OH-)+c(CN-) |