醋酸溶液中存在电离平衡CH3COOH H++CH3COO-,下列叙述不正确的是
H++CH3COO-,下列叙述不正确的是
| A.0.10mol/L醋酸溶液中粒子浓度的关系满足:c(CH3COOH)>c(H+)>c(CH3COO-)>c(OH-) |
| B.0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)减小 |
| C.CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动 |
| D.常温下pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液pH<7 |
下列有机物命名正确的是 ( )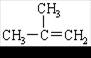
A.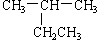 2-乙基丙烷 2-乙基丙烷 |
B.CH3CH2CH2CH2OH 1-丁醇 |
C.CH3- -CH3间二甲苯 -CH3间二甲苯 |
D.2-甲基-2-丙烯 |
下列通式只表示一类物质的是( )
| A.CnH2n+2 | B.CnH2n | C.CnH2n-2 | D.CnH2n-6 |
与丙烯具有相同的碳、氢百分含量,但既不是同系物又不是同分异构体的是( )
| A.环丙烷 | B.环丁烷 | C.乙烯 | D.丙烷 |
2005年11月13日中国石油吉林石化公司双苯厂发生爆炸事故,大量硝基苯泄漏,引起松花江水污染,安全生产和环保问题再次引起人们的关注.下列关于硝基苯的叙述正确的是( )
| A.硝基苯是一种油状物质,会浮在水面上 |
| B.实验室制硝基苯需要用水浴加热 |
| C.硝基苯中毒是由蒸气吸入或误食引起的,与皮肤接触不会引起中毒 |
| D.硝基苯是由苯酚和硝酸直接反应生成的 |
“绿色化学”是当今社会提出的一个新概念。在“绿色化学”工艺中,理想状态是反应物中原子全部转化为欲制得产物,即原子利用率100%。以下反应最符合绿色化学的是( )
| A.CH2=CH2与HCl反应制取CH3CH2Cl | B.乙醇和浓硫酸共热制乙烯 |
| C.苯与液溴反应制取溴苯 | D.乙醇与金属钠反应制取乙醇钠 |