在一定条件下,下列反应达到平衡时,反应物的转化率均为a%,
① PCl5(g)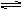 PCl3(g)+Cl2(g)
PCl3(g)+Cl2(g)
② 2HI(g)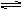 H2(g)+I2(g)
H2(g)+I2(g)
③ 2NO2(g)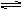 N2O4(g)
N2O4(g)
若保持各自的温度、体积不变,分别加入一定量的各自的反应物,则转化率
| A.均不变 | B.均增大 | C.①增大②不变③减小 | D.①减小②不变③增大 |
巴豆酸的结构简式为CH3—CH="=" CH—COOH。现有①氯化氢、②溴水、③纯碱溶液、④2丁醇、⑤酸化的KMnO4溶液,试根据巴豆酸的结构特点,判断在一定条件下,能与巴豆酸反应的物质是( )
| A.只有②④⑤ | B.只有①③④ |
| C.只有①②③④ | D.①②③④⑤ |
下列物质中,不属于羧酸类有机物的是( )
| A.乙二酸 | B.苯甲酸 | C.硬脂酸 | D.石炭酸 |
下列物质在氧气中燃烧只生成CO2和H2O的是( )
| A.烷烃 | B.卤代烃 | C.蛋白质 | D.橡胶 |
下列反应中,有机物被还原的是( )
| A.乙醛的银镜反应 | B.乙醛制乙醇 | C.乙醇制乙醛 | D.乙醇制乙烯 |
有4种化合物 (1) NaHCO3、(2) Al (OH)3、(3) (NH4)2S、(4) H2N—CH2一COOH,其中跟盐酸和氢氧化钠都能反应的是( )
| A.只有(2) (4) | B.只有(1) (2) |
| C.只有(1) (2) (3) | D.(1) (2) (3) (4) |