下列说法不正确的是
| A.已知冰的熔化热为6.0 kJ/mol,冰中氢键键能为20 kJ/mol,假设1 mol冰中有2 mol 氢键,且熔化热完全用于破坏冰的氢键,则最多只能破坏冰中15%的氢键 |
B.已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为α,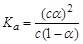 。若加入少量醋酸钠固体,则CH3COOH 。若加入少量醋酸钠固体,则CH3COOH CH3COO-+H+向左移动,α减小,Ka变小 CH3COO-+H+向左移动,α减小,Ka变小 |
| C.实验测得环己烷(l)、环己烯(l)和苯(l)的标准燃烧热分别为-3916 kJ/mol、-3747 kJ/mol和-3265 kJ/mol,可以证明在苯分子中不存在独立的碳碳双键 |
D.已知:Fe2O3(s)+3C(石墨) 2Fe(s)+3CO(g),△H=+489.0 kJ/mol。 2Fe(s)+3CO(g),△H=+489.0 kJ/mol。 |
CO(g)+1/2O2(g) CO2(g),△H=-283.0 kJ/mol。
CO2(g),△H=-283.0 kJ/mol。
C(石墨)+O2(g) CO2(g),△H=-393.5 kJ/mol。
CO2(g),△H=-393.5 kJ/mol。
则4Fe(s)+3O2(g) 2Fe2O3(s),△H=-1641.0 kJ/mol
2Fe2O3(s),△H=-1641.0 kJ/mol
NO2通过盛有水的洗气瓶,转移0.03mol电子时,参加反应的NO2气体在标准状况下的体积为
| A.224mL | B.336mL | C.448mL | D.672mL |
下列说法正确的是
| A.HClO中氯元素化合价比HClO4中氯元素化合价低,所以,HClO4的氧化性强 |
| B.已知①Fe + Cu2+ = Fe2+ + Cu;② 2Fe3+ + Cu = 2Fe2+ + Cu2+,则氧化性强弱顺序为: Fe3+ > Cu2+ > Fe2+ |
| C.已知还原性:B- > C-> D-,反应 2C- + D2 = 2D- +C2和反应 2C- + B2 = 2B- +C2都能发生 |
| D.具有强氧化性和强还原性的物质放在一起就能发生氧化还原反应 |
下列反应的离子方程式表示正确的是
| A.澄清石灰水中通入过量二氧化碳:OH-+CO2 =HCO3- |
| B.铜片跟三氯化铁溶液反应:Fe3++Cu =Cu2++Fe2+ |
| C.漂白粉溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O =CaSO3↓+2HClO |
| D.Fe3O4与稀HNO3反应:Fe3O4+8H+ =Fe2++2Fe3++4H2O |
下列做法存在安全隐患或导致实验失败的是
| A.将1mol·L-1FeCl3溶液滴入沸水中制备Fe(OH)3胶体 |
| B.氢气还原氧化铜实验中,先通氢气后加热氧化铜 |
| C.将FeCl3稀溶液加热蒸发浓缩制备FeCl3浓溶液中 |
| D.用烧瓶加热液体时投入碎瓷片以防暴沸 |
对于Cl2+SO2+2H2O =H2SO4+2HCl反应,下列说法正确的是
①Cl2是氧化剂 ②SO2被氧化 ③Cl2被氧化 ④Cl2发生还原反应
⑤SO2具有还原性 ⑥Cl2具有氧化性
| A.只有①②⑥ | B.只有②③④ | C.只有②④⑤⑥ | D.只有①②④⑤⑥ |