已知N2(g)+3H2(g)  2NH3(g),现向一密闭容器中充入1molN2和3molH2,在高温、高压和催化剂存在条件下发生反应。下列有关说法正确的是( )
2NH3(g),现向一密闭容器中充入1molN2和3molH2,在高温、高压和催化剂存在条件下发生反应。下列有关说法正确的是( )
| A.最终可以生成2mol NH3 |
| B.达到化学平衡状态时,正反应和逆反应的速率都为0 |
| C.达到化学平衡状态时,容器中N2、H2和NH3的物质的量之比为1∶3∶2 |
| D.达到化学平衡状态时,N2、H2和NH3的物质的量浓度不再变化 |
短周期元素A、B、C、D、E是同周期的五种元素,A和B的最高价氧化物对应水化物呈碱性,且碱性B>A,C和D的气态氢化物的稳定性C>D,五种元素形成的简单离子中E的离子半径最小,则它们的原子序数由小到大的顺序是()
A.C、D、E、A、BB.E、C、D、A、B
C.B、A、D、C、E D.B、A、E、D、C
在一个的固定容积的密闭容器中,可逆反应:2 SO2+ O2  2 SO3达到平衡的标志是
2 SO3达到平衡的标志是
| A.SO2、O2、SO3的浓度之比为 2 : 1 : 2 |
| B.SO2、O2、SO3的浓度均不再变化 |
| C.单位时间内消耗1molO2同时生成2molSO3 |
| D.SO2、O2、SO3共存 |
下列装置烧杯中盛放的都是稀硫酸,在铜上能产生大量气泡的是 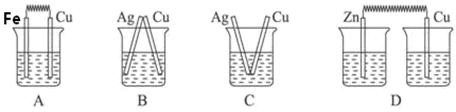
下表为部分短周期元素的原子半径及主要化合价,根据表中信息判断,下列叙述正确的是
| 元素代号 |
X |
Y |
Z |
M |
N |
| 原子半径/nm |
0.160 |
0.143 |
0.102 |
0.071 |
0.099 |
| 主要化合价 |
+2 |
+3 |
+6、-2 |
-1 |
-1 |
A.X、Y最高价氧化物对应水化物的碱性:Y>X
B.最高价氧化物对应的水化物的酸性: H2ZO4>HNO4
C.气态氢化物的稳定性:HM<H2Z
D.M、N形成的简单离子的还原性:N->M-
下列说法不正确的是
| A.化学反应的实质是旧键的断裂,新键的形成 |
| B.石墨转化为金刚石的反应是吸热反应,说明金刚石比石墨稳定 |
| C.原电池反应的实质是自发进行的氧化还原反应 |
| D.元素周期律的实质是元素原子核外电子排布呈周期性变化 |