已知某有机物的式量是58,根据下列条件回答有关问题:
(1)若该有机物只由碳、氢两种元素组成,写出所有可能的结构简式为 、 。
(2)若该有机物为含氧衍生物,则分子中有2个—CH3,则结构简式为 。
(3)若该含氧衍生物的分子中无—CH3,又无—OH,但能发生银镜反应,则结构简式为 。
(6分)已知烯烃、炔烃在臭氧作用下发生以下反应:
CH3—CHCH—CH2—CH==CH2 CH3CHO+OHC—CH2—CHO+HCHO
CH3CHO+OHC—CH2—CHO+HCHO
CH3—C≡C—CH2—C≡CH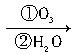 CH3COOH+HOOCCH2COOH+HCOOH
CH3COOH+HOOCCH2COOH+HCOOH
某烃化学式为C10H10,在臭氧作用下发生反应:
C10H10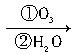 CH3COOH+3HOOC—CHO+CH3CHO
CH3COOH+3HOOC—CHO+CH3CHO
(1)C10H10分子中含_______________个双键,_______________个三键。
(2)C10H10结构简式为____________________________________________________________。
(4分)在300 ℃时,5 L密闭容器内,分子式为A2和B2的两种气体反应,生成另一种气体C,其反应情况如图所示:则该反应的化学方程式为:__________________;A2的平均反应速率为_________。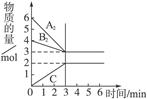
一定条件下,将SO2和O2充入一密闭容器中,发生如下反应:
2SO2(g)+O2(g) 2SO3(g)(正反应放热)
2SO3(g)(正反应放热)
反应过程中SO2、O2、SO3物质的量变化如图2-61所示:
图2-61
完成下列问题:
(1)降低温度,SO2的转化率____________,化学反应速度____________。(填“增大”“减小”或“不变”)
(2)反应处于平衡状态的时间是____________。
(3)反应进行至20 min时,曲线发生变化的原因是________________________ (用文字表达)。10 min到15 min的曲线变化的原因可能是____________(填写编号)。
a.加了催化剂
b.缩小容器体积
c.降低温度
d.增加SO3的物质的量
在密闭容器中发生下列反应:
I2(g)+H2(g) 2HI(g)(正反应吸热)
2HI(g)(正反应吸热)
起始时,n(H2)="a" mol,n(I2)="b" mol。只改变表中列出的条件,其他条件不变,试将化学反应速率的改变(“增大”“减小”或“不变”)填入相应的表格。
| 编号 |
反应条件 |
反应速率 |
| (1) |
升高温度 |
|
| (2) |
加入催化剂 |
|
| (3) |
再充入a mol H2 |
|
| (4) |
将容器容积扩大原来2倍 |
|
| (5) |
通入b mol Ne(g) |
法常用于处理含难降解有机物的工业废水,通常是在调节好
和
浓度的废水中加入
,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物
,探究有关因素对该降解反应速率的影响。 [实验设计]控制
的初始浓度相同,恒定实验温度在298
或313
(其余实验条件见下表),设计如下对比试验。
[实验设计]控制
的初始浓度相同,恒定实验温度在298
或313
(其余实验条件见下表),设计如下对比试验。 (1)请完成以下实验设计表(表中不要留空格)。
(1)请完成以下实验设计表(表中不要留空格)。
实验 编号 编号 |
实验目的 |
||||
| ① |
为以下实验作参考 |
298 |
3 |
6.0 |
0.30 |
| ② |
探究温度对降解反应速率的影响 |
||||
| ③ |
 |
298 |
10 |
6.0 |
0.30 |
 [数据处理]实验测得
的浓度随时间变化的关系如右上图。
[数据处理]实验测得
的浓度随时间变化的关系如右上图。

(2)请根据右上图实验①曲线,计算降解反应在50~150
内的反应速率: (
)=
(
)=
 [解释与结论]
[解释与结论] (3)实验①、②表明温度升高,降解反应速率增大。但温度过高时反而导致降解反应速率减小,请从
法所用试剂
的角度分析原因:。
(3)实验①、②表明温度升高,降解反应速率增大。但温度过高时反而导致降解反应速率减小,请从
法所用试剂
的角度分析原因:。 (4)实验③得出的结论是:
等于10时,。
(4)实验③得出的结论是:
等于10时,。 [思考与交流]
[思考与交流] (5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来。根据上图中的信息,给出一种迅速停止反应的方法:
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来。根据上图中的信息,给出一种迅速停止反应的方法: