根据键能数据估算CH4 (g)+4F2 (g) =CF4+4HF(g)的反应热ΔH为( )
| 化学键 |
C—H |
C—F |
H—F |
F—F |
| 键能/(kJ/mol) |
414 |
489 |
565 |
155[ |
A.–1940 kJ · mol-1 B.1940 kJ · mol-1 C.–485 kJ · mol-1 D.485 kJ · mol-1
下列关于油脂的叙述不正确的是( )
| A.油脂属于酯类 |
| B.油脂没有固定的熔、沸点 |
| C.油脂是高级脂肪酸甘油酯 |
| D.油脂都不能使溴水退色 |
中药狼把草的成分之一M具有消炎杀菌作用,M的结构如图所示:下列叙述正确的是( )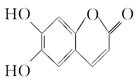
| A.M的相对分子质量是180 |
| B.1 mol M最多能与2 mol Br2发生反应 |
| C.M与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H4O5Na4 |
| D.1 mol M与足量NaHCO3反应能生成2 mol CO2 |
如图为实验制取少量乙酸乙酯的装置图,下列关于该实验的叙述中,不正确的是( )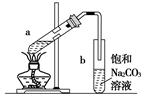
| A.向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇和冰醋酸 |
| B.试管b中导气管下端管口不能浸入液面的目的是防止实验过程中产生倒吸现象 |
| C.实验时加热试管a的目的之一是及时将乙酸乙酯蒸出,使平衡向生成乙酸乙酯的方向移动 |
| D.试管b中饱和Na2CO3溶液可吸收随乙酸乙酯蒸出的少量乙酸和乙醇 |
东风汽车装有的一种尾气处理装置使用铂做催化剂,可将CO、NO、NO2和碳氢化合物等转化为无害的物质,有效降低了尾气对环境的危害。下列有关说法中不正确的是( )
| A.铂表面被做成蜂窝状更有利于提高催化效果 |
| B.在铂催化下,NO可被CO氧化为N2 |
| C.尾气处理装置使用铂做催化剂可加快CO的氧化 |
| D.碳氢化合物在铂催化下,可直接将CO氧化为CO2 |
在实验室里用铁屑、氧化铜、稀硫酸为原料制备铜,有下列两种途径:
(1)Fe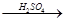 H2
H2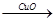 Cu
Cu
(2)CuO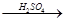 CuSO4
CuSO4 Cu
Cu
若用这两种方法制得等量的铜,下列说法符合实际情况的是( )
| A.消耗氧化铜的质量相同 |
| B.消耗铁的质量相同 |
| C.消耗硫酸的质量相同 |
| D.生成硫酸亚铁的质量相同 |