已知一定温度下,N2和H2 反应生成2mol NH3时放出的热量为92.0 kJ,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为( )[忽略能量损失]
| A.一定大于92.0 kJ | B.一定等于92.0 kJ | C.一定小于92.0 kJ | D.不能确定 |
100℃时,将0.1 mol N2O4置于1 L密闭的烧瓶中,然后将烧瓶放入100℃的恒温槽中,烧瓶内的气体逐渐变为红棕色:N2O4(g)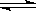 2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到反应限度的是
2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到反应限度的是
| A.N2O4的消耗速率与NO2的生成速率之比为1∶2; |
| B.烧瓶内气体的颜色不再加深; |
| C.烧瓶内气体的平均相对分子质量不再变化; |
| D.烧瓶内气体的压强不再变化。 |
25 ℃时,在等体积的①pH=0的H2SO4溶液,②0.05 mol·L-1的Ba(OH)2溶液中,发生电离的水的物质的量之比是()
| A.1∶10 | B.1∶5 | C.1∶20 | D.1∶10 |
下列有关化学平衡常数K的说法中,正确的是( )
| A.K的大小与起始浓度有关 |
| B.温度越高,K值越大 |
| C.K值越大,反应物的转化率越大 |
| D.K值越大,正向反应进行的程度越小 |
某可逆反应过程的能量变化如图所示,下列说法正确的是( )
| A.该反应过程为吸热反应 |
| B.若加入催化剂,B点会降低 |
| C.若加入催化剂,△H数值会减小 |
| D.若升高温度,则平衡向正反应方向移动 |
某学生的实验报告所列出的下列数据中合理的是( )
| A.用10mL量筒量取7.13mL稀盐酸 |
| B.用托盘天平称量25.20gNaCl |
| C.用pH试纸测得某溶液的pH为2.3 |
| D.中和滴定时用去某浓度的碱溶液21.70mL |