下列反应中,观察不到颜色变化的是 ( )
| A.NaOH溶液中通入CO2气体 | B.往品红溶液中通人足量二氧化硫气体 |
| C.氯化铁溶液中滴入KSCN溶液 | D.NaOH溶液中滴入酚酞试液 |
甲基丙烯酸甲酯是世界上年产量超过100万吨的高分子单体,旧法合成的反应是:(CH3)2C===O+HCN―→(CH3)2C(OH)CN,(CH3)2C(OH)CN+CH3OH+H2SO4―→CH2===C(CH3)COOCH3+NH4HSO4。20世纪90年代新法的反应是:CH3C CH+CO+CH3OH
CH+CO+CH3OH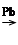 CH2===C(CH3)COOCH3,与旧法比较,新法的优点是( )
CH2===C(CH3)COOCH3,与旧法比较,新法的优点是( )
| A.原料无爆炸危险 |
| B.原料都是无毒物质 |
| C.没有副产物,原料利用率高 |
| D.条件比较简单 |
由CH3CH3→CH3CH2Cl→CH2=CH2→CH3CH2OH的转化过程中,经过的反应是( )
| A.取代→加成→氧化 | B.裂解→取代→消去 |
| C.取代→消去→加成 | D.取代→消去→水解 |
分子式为C5H10O2的有机物在酸性条件下可水解为酸和醇,若不考虑立体异构,这些醇和酸重新组合可形成的酯共有( )
| A.15种 | B.28种 | C.32种 | D.40种 |
在一定条件下,动植物油脂与醇反应可制备生物柴油,化学方程式如下: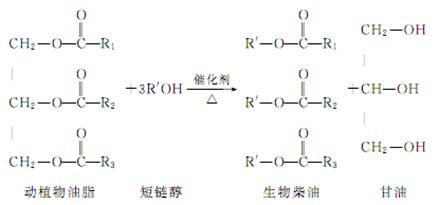
下列叙述错误的是( )
| A.生物柴油由可再生资源制得 |
| B.生物柴油是不同酯组成的混合物 |
| C.动植物油脂是高分子化合物 |
| D.“地沟油”可用于制备生物柴油 |
药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得:
下列有关叙述正确的是( )
| A.贝诺酯分子中有三种含氧官能团 |
| B.可用FeCl3溶液区别乙酰水杨酸和对乙酰氨基酚 |
| C.乙酰水杨酸和对乙酰氨基酚均能与NaHCO3溶液反应 |
| D.贝诺酯与足量NaOH 溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠 |