(1)下列措施错误的是 (填序号):①稀释浓硫酸时,将水缓慢注入浓硫酸中;②用熟石灰处理被酸污染的河水;③把鼻孔凑到容器口闻浓盐酸的气味④不慎将浓硫酸沾到皮肤上,立即用大量水冲洗,再涂上3%~5%的碳酸氢钠溶液
(2)长江中学化学兴趣小组,用自制的酸碱指示剂对NaCl、NaOH、HCl等溶液的酸碱性进行测定,结果记录如下:
| 植物的汁液 |
在HCl溶液中 |
在NaCl溶液中 |
在NaOH溶液中 |
| 牵牛花瓣 |
红 色 |
紫 色 |
蓝 色 |
| 胡萝卜 |
橙 色 |
橙 色 |
橙 色 |
| 月季花瓣 |
浅红色 |
红 色 |
黄 色 |
①经过探究,发现 根本不宜作酸碱指示剂,这三种物质中理想的指示剂是 。
②小明是一个勤思考,爱钻研的同学,发现了牵牛花瓣汁液遇NaOH溶液变蓝色后,思考到了一个问题:NaOH溶液中到底是哪种粒子使牵牛花汁液显蓝色呢?于是他和同学们继续探究:
【提出问题】NaOH溶液中何种粒子使牵牛花汁液发生颜色改变?
【提出猜想】猜想1:使牵牛花汁液变色的粒子是H2O
猜想2:使牵牛花汁液变色的粒子是
猜想3:使牵牛花汁液变色的粒子是 。
【设计实验】
| 实 验 步 骤 |
实验现象 |
实 验 结 论 |
| 1.向盛有少量蒸馏水的试管里,滴加2滴牵牛花汁液,振荡 |
溶液呈紫色 |
使牵牛花汁液变色的不是 |
| 2.向盛有少量氯化钠溶液的试管里,滴加2滴牵牛花汁液,振荡 |
溶液呈紫色 |
使牵牛花汁液变色的不是 |
| 3.向盛有少量氢氧化钠溶液的试管里,滴加2滴牵牛花汁液,振荡 |
溶液呈蓝色 |
使牵牛花汁液变色的只能是 |
【交流反思】实验完成后,继续讨论发现,还有更简单的方法,请你用文字或图示设计出更简单的方案:
小青看见爸爸种花时把草木灰洒在花盆中作肥料,她查阅资料得知草木灰的主要成分是一种含钾的化合物。于是她取一些草木灰做了以下实验,请你帮助她将下列实验报告填写完整:
| 实验序号 |
实验目的 |
实验方案 |
实验现象 |
结论 |
| 实验1 |
 |
① ② |
草木灰的主要成分是碳酸钾 |
|
| 实验2 |
探究碳酸钾的性质 |
向碳酸钾溶液中滴入澄清石灰水 |
有白色沉淀生成 |
化学方程式为 |
| 实验3 |
探究实验2反应后上层清液中溶质的成份 |
上层清液中有两种溶质和 |
[反思]实验过程中产生的废液必须处理后再排放。请你对实验2反应后产生的废液处理提出可行的方法。
(6分)超市中的许多食物用保鲜膜包装后出售。保鲜膜为什么可以“保鲜”呢?
[设计实验]在A、B、C三只相同的玻璃杯中,分别注入等体积的蒸馏水,并在各玻璃杯外壁标明刻度,如图所示放置一周。
[实验现象]一周后发现:A杯中的水量几乎不变;而C杯中的水量减少较多;
B杯中的现象是;
[解释]请用分子的知识解释C杯中水量减少的原因:
;
[结论]保鲜膜除了可以阻止食物中水分流失,还能隔绝,防止食物腐败。
[提出新问题]制作保鲜膜的材料是热固性塑料还是热塑性塑料呢?
[实验]在一只试管中放入少量保鲜膜碎片,用酒精灯缓缓加热,观察到碎片熔化,冷却后变成固体,加热又可以熔化。由此得出:制作保鲜膜的材料是(填“热塑性”或“热固性”)塑料。
[反思] (1)保鲜膜虽然能延长食品的保鲜期,但大量使用后丢弃会造成,所以要控制使用。
(2) 化学物质可以造福人类,但有时也会给人类带来危害,请你再举一例说明
。
(10大连56).某工厂在生产过程中产生甲、乙两种废水。甲废水中主要含有硫酸和硫酸镁;乙废水中主要含有氢氧化钠(其他成分含量很少,可忽略)。为了研究废水处理方案,某活动小组取来一定量该工厂的甲、乙两种废水,在实验室里进行模拟实验。要求不外加其他试剂,使处理后的废水呈中性并回收得到硫酸镁固体。写出实验步骤。
提示:2NaOH+MgSO4=Na2SO4+Mg(OH)2↓
(10大连55).现有粗铜粉末,其中含有少量的铁、锌和金。某活动小组想要测定其中铜的质量分数,设计以下实验方案:
步骤Ⅰ:称取一定质量的粗铜样品,加入过量的稀盐酸充分反应,过滤,将滤渣洗涤、干燥后称量;
步骤Ⅱ:去“步骤Ⅰ”中所得滤渣在空气中充分灼烧,冷却到室温后称量;
步骤Ⅲ:根据测得数据推算出粗铜中铜的质量分数。
⑴步骤Ⅰ:验证稀盐酸过量的方法是_________;如果不对滤渣进行洗涤而直接干燥,称量结果将会(填“偏高”或“偏低”)。
⑵“步骤Ⅱ”中反应的化学方程式为___________________;
⑶某同学认为,按以上方案完成“步骤Ⅰ”,在进行“步骤Ⅱ”时,将所得滤渣在空气中充分灼烧后,再补充适当操作,也可以推算出粗铜中铜的质量分数。写出补充的操作。
(10哈尔滨 36).甲、乙同学在学完酸的化学性质后,做了如下实验: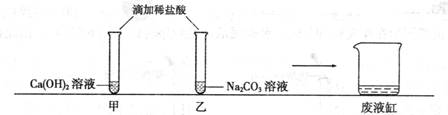
实验结束,甲、乙同学依次将废液缓慢倒入同一洁净的废液缸中,然后进行了讨论。
【观察与讨论1】甲同学在做实验时没有观察到明显现象,于是对氢氧化钙溶液和稀盐酸能发生反应表示怀疑。但乙同学认为,甲同学实验时向氢氧化钙溶液中应先滴几滴酚酞试液,再滴加适量的稀盐酸,当观察到(1)时。就可以说明两种物质能发生反应。
【观察与讨论2】当乙同学沿废液缸内壁缓慢倾倒液体时,观察到废液缸中先有气泡产生,然后又出现了白色沉淀。经过讨论确定,甲、乙同学试管中废液含有的溶质分别是(2)
(3)(均写化学式),才会出现上述现象。
为了科学处理试验后产生的废液,甲、乙同学决定对废液缸中最终废液溶质的成分进行探究。
【提出问题】最终废液中含有什么溶质?
【猜想与假设】甲同学猜想:废液中含有NaCl、CaCl2两种物质
乙同学猜想:废液中含有NaCl、Na2CO3两种物质
【活动与探究】甲、乙同学为了验证自己的猜想分别同时进行了如下实验:
甲同学实验:取少量废液于试管中,向其中滴加碳酸钠溶液,无明显现象。
得出结论:甲猜想不成立,则 乙猜想成立。
乙同学实验:取少量废液于试管中,向其中滴加氯化钙溶液,出现白色沉淀。
得出结论:乙猜想成立,则甲猜想不成立。
【反思与评价】请对甲同学由实验现象得出的结论给予评价(4)。
【表达与交流】甲、乙同学确认了最终废液中溶质的成分。你认为处理该废液的方法是
(5)。