可逆反应2SO2(g)+O2(g) 2SO3(g),△H<0。在一定条件下达到平衡状态,时间为t1时改变条件,反应速率与时间关系如图,下列说法正确的是
2SO3(g),△H<0。在一定条件下达到平衡状态,时间为t1时改变条件,反应速率与时间关系如图,下列说法正确的是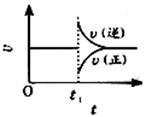
| A.维持温度与容积不变,t1时充入SO3(g) |
| B.维持压强不变,t1时升高温度 |
| C.维持温度不变,t1时扩大容积 |
| D.维持温度和压强不变,t1时充入SO3(g) |
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的一种反应原理如下:
CH3OH(g) + H2O(g) → CO2(g) + 3H2(g) – 49.0 kJ
下列说法正确的是
| A.1 LCH3OH蒸汽与1 L水蒸汽反应生成1 L CO2气体与3 L氢气吸收热量49.0 kJ |
| B.1个CH3OH分子与1个水分子反应生成1个CO2分子与3个H2分子吸收49.0 kJ热量 |
| C.相同条件下1molCH3OH(g)与1mol H2O(g)的能量总和小于1molCO2(g)与3 mol H2(g)的能量总和 |
| D.1 molCH3OH蒸汽与1 mol液态水反应生成1mol CO2气体与3 mol 氢气吸收的热量小于49.0 kJ |
物质的变化需要改变微粒之间的相互作用,所克服的作用属于同种类型的是
| A.Br2(l)和I2(s)分别受热气化 | B.NaBr和HI分别在水中电离 |
| C.硅和铁分别受热熔化 | D.氯化氢和蔗糖分别溶解于水 |
某无色溶液中滴入石蕊试液显红色,该溶液中可以大量共存的是
| A.Na+、Cl-、Mg2+、ClO- | B.Fe2+、NH4+、Cl-、NO3一 |
| C.Na+、HCO3-、AlO2一、K+ | D.Na+、Ba2+、Cl-、NO3一 |
图示化学变化的类型属于
| A.取代 | B.水解 | C.中和 | D.电离 |
物质发生化学变化时常伴有颜色变化,两者对应正确的有
| A.金属钠在空气中燃烧:银白色变白色 |
| B.纯铁丝在氧气中燃烧:黑色变红色 |
| C.苯、浓硫酸、浓硝酸混合溶液受热:无色变浅黄色 |
| D.用H2SO4(aq)滴定NaHCO3(aq)(甲基橙为指示剂):溶液橙色变黄色 |