现有①0.2mol/L NaOH溶液和②0.2mol/L HX溶液,两溶液等体积混合后,测得溶液中c(Na+)>c(X—)。则:
(1)①中由水电离出的c(OH-)__ ②中由水电离出的c(H+)。(填“>”、“=”或“<”)
(2)上述混合液中共存在 种粒子。其中:c(HX)+c(X—) 0.1mol/L(忽略混合前后溶液体积变化)(填“>”、“=”或“<”)。请根据电荷守恒写出一个用离子浓度表示的式子: 。
(3)上述混合液显 性(填“酸”、“碱”或“中”),其原因用离子方程式表示为 。
有A、B、C三种元素,其核电荷数之和为32,A为原子核内有12个中子的金属元素,形成化合物时显+2价,当2.4 g单质A与足量稀硫酸反应时,产生2.24 L H2(标准状况)。B有两个电子层,且各电子层的电子数与电子层总数相等。
(1)写出元素A、B、C的名称及元素符号:A_____,B_____,C_____。
(2)A2+、B、C2-的结构示意图分别是________,________,________。
下列粒子中:(其中P表示质子,n表示中子,e-表示电子)
| A.12P,12n,10e- | B.14P,14n,14e- |
| C.17P,18n,17e- | D.17P,20n,17e- |
E.17P,18n,18e- F.17P,20n,18e-
属于原子的是_____(填编号,下同);属于阳离子的是____;属于阴离子的是____;属于同一种元素的粒子是____。
填写下列符号中“2”的含义。
(1)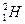 _______________________________。
_______________________________。
(2)H2_________________________________。
(3)Ca2+________________________________。
(4) _______________________________。
_______________________________。
(5)2He________________________________。
(6)2Cl________________________________。
完成下面表格:
根据下列反应框图填空,已知反应①是工业上生产化合物D的反应,反应⑤是实验室鉴定化合物E的反应
(1)单质L是________。
(2)化合物B是________。
(3)图中除反应①以外,还有两个用于工业生产的反应,是________和________(填代号)。
它们的化学反应方程式分别是____________________和___________________。