下列说法中,不正确的是
| A.若反应时形成新化学键释放的能量大于破坏旧化学键所吸收的能量,则化学反应是放热反应 |
| B.若反应物的总能量大于生成物的总能量,则化学反应为放热反应 |
| C.Ba(OH)2•8H2O晶体与NH4Cl固体的反应是放热反应 |
| D.化学反应在发生物质变化的同时,一定伴随着能量的变化 |
下列说法正确的是()
| A.难溶电解质作比较时,Ksp小的,溶解度一定小 |
| B.Ksp大小取决于难溶电解质的量,所以离子浓度改变时,沉淀溶解平衡会发生移动 |
| C.所谓沉淀完全就是用沉淀剂将溶液中某一离子完全除去 |
| D.温度一定,当溶液中Ag+和Cl-浓度的乘积等于Ksp时,溶液为AgCl的饱和溶液 |
H2SO3是二元弱酸,NaHSO3溶液呈酸性。在0.1 mol·L-1 NaHSO3溶液中,下列关系正确的是()
| A.c(HSO3-)>c(SO32-)>c(H2SO3) |
| B.c(Na+)=c(HSO3-)+2c(SO32-)+c(H2SO3) |
| C.c(Na+)=c(HSO3-)>c(H+)>c(OH-) |
| D.c(Na+)+c(H+)=c(HSO3-)+c(OH-)+c(SO32-) |
25 ℃时,在1.0 L浓度均为0.01 mol·L-1的某一元酸HA与其钠盐组成的混合溶液中测得c(Na+)>c(A-),则下列描述中不正确的是()
A.该溶液的pH<7
B.HA的酸性很弱,A-水解程度较大
C.c(A-)+c(HA)=0.02 mol·L-1
D.n(A-)+n(OH-)=0.01 mol+n(H+)
下列叙述正确的是()
| A.将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+) |
| B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2 |
| C.pH=11的NaOH的溶液与pH=3的醋酸溶液等体积混合,滴入石蕊试液呈红色 |
D.向0.1 mol/L的氨水中加入少量硫酸铵固体,则溶液中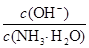 增大 增大 |
已知在常温下测得浓度均为0.1 mol·L-1的下列三种溶液的pH:
| 溶质 |
NaHCO3 |
Na2CO3 |
NaCN |
| pH |
9.7 |
11.6 |
11.1 |
下列说法中正确的是()
A.阳离子的物质的量浓度之和:
Na2CO3>NaCN>NaHCO3
B.相同条件下的酸性:H2CO3<HCN
C.三种溶液中均存在电离平衡和水解平衡
D.升高Na2CO3溶液的温度, 减小
减小