铅蓄电池是广泛应用于汽车、柴油机车等的启动电源。产生电能时的电极反应分别为:
Pb+SO42―–2e―=PbSO4 ①
PbO2+4H++SO42―+2e―=PbSO4+2H2O ②
下列有关铅蓄电池的说法不正确的是:
| A.①式表示负极反应,②式表示正极反应 |
| B.铅蓄电池的电解质溶液是硫酸溶液,在放电过程中,它的浓度逐渐降低 |
| C.铅蓄电池在放电时,电子从Pb通过导线流向PbO2 |
| D.铅蓄电池在充电时,原来负极发生的反应是:Pb+SO42―–2e―=PbSO4 |
下图为常温下用0.1000 mol·L-1 NaOH溶液滴定20.00 mL 0.1000 mol·L-1盐酸和20.00 mL 0.1000 mol·L-1醋酸的曲线。若以HA表示酸,下列判断和说法正确的是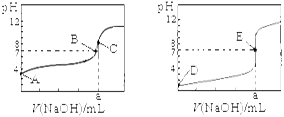
A.左图是滴定盐酸的曲线
B.E点时溶液中离子浓度为c(Na+) = c(A—)
C.B点时,反应消耗溶液体积:V(NaOH) <V(HA)
D.当0 mL< V(NaOH) < 20.00 mL时,对应溶液中各离子浓度大小顺序一定均为c(A-) >c(Na+)> c(H+) > c(OH-)
下列叙述错误的是
| A.电镀时,待镀的金属制品作阳极 |
| B.用惰性电极电解CuSO4溶液,溶液pH增大 |
| C.氢氧燃料电池(酸性电解质)中,正极反应为O2+4H++4e- = 2H2O |
| D.镀锌铁皮比镀锡铁皮耐腐蚀 |
下述实验不能到达预期目的的是
| 编号 |
实验内容 |
实验目的 |
| A |
向FeCl2溶液中加入几滴KSCN溶液,观察溶液颜色 |
检验FeCl2溶液是否已变质 |
| B |
将Cl2通入NaBr溶液中 |
比较氯气与溴的氧化性强弱 |
| C |
用冰水冷却铜与浓硝酸反应生成的气体 |
研究温度对化学平衡的影响 |
| D |
直接将CuCl2溶液加热蒸干 |
制取无水CuCl2固体 |
下表为元素周期表前四周期的一部分,下列叙述正确的是
| X |
|||
| Y |
Z |
R |
|
| W |
A.Y单质在空气中燃烧生成YO3
B.Z元素的最高价氧化物的水化物酸性最强
C.X的氢化物为H2X
D.Y、Z和W的阴离子半径依次增大
下列叙述正确的是
| A.电解饱和食盐水能制得NaOH |
| B.澄清石灰水能鉴别Na2CO3和NaHCO3 |
| C.配制溶液,定容时俯视容量瓶刻度会使溶液浓度偏低 |
| D.铁粉中混入少量铝粉,可加入过量的氨水后过滤除去 |