化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如下图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化:
下列说法正确的是( )
| A.1 mol N2(g)和1 mol O2(g)反应放出的能量为180 kJ |
| B.1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量 |
| C.通常情况下,N2(g)和O2(g)混合能直接生成NO |
| D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 |
在不同条件下分别测得反应2SO2+O2 2SO3的化学反应速率,表示该反应速率最快的是()
2SO3的化学反应速率,表示该反应速率最快的是()
| A.v (SO2)=4mol/(L·min) | B.v (O2)=3mol/(L·min) |
| C.v (SO2)=0.1mol/(L·s) | D.v (O2)=0.1mol/(L·s) |
已知反应X+Y= M+N为放热反应,,对该反应的下列说法中正确的( )
| A.X的能量一定高于M |
| B.Y的能量一定高于N |
| C.X和Y的总能量一定高于M和N的总能量 |
| D.因该反应为放热反应,故不必加热就可发生 |
用铁片于稀硫酸反应制备氢气时,下列措施不能使氢气生成速率加快的是()
| A.加热 | B.不用稀硫酸,改用98%浓硫酸 |
| C.滴加少量CuSO4溶液 | D.不用铁片,改用铁粉 |
下列关于反应热的说法正确的是 ( )
| A.当∆H﹤0时,表示该反应为吸热反应 |
B.已知C(s)+ O2(g)=CO(g)△H=-110.5kJ/mol,说明碳的燃烧热为110.5kJ/mol O2(g)=CO(g)△H=-110.5kJ/mol,说明碳的燃烧热为110.5kJ/mol |
| C.反应热的大小与反应物所具有的能量和生成物所具有的能量无关 |
| D.化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关 |
从如图所示的某气体反应的能量变化分析,以下判断错误的是 ( )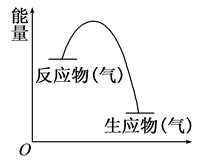
| A.这是一个放热反应 | B.该反应可能需要加热 |
| C.生成物的总能量低于反应物的总能量 | D.反应物比生成物更稳定 |