X、Y是第二或第三周期的同周期元素,它们可以形成离子化合物XmYn,且离子均具有稀有气体的电子层结构,若X的原子序数为a,则Y的原子序数可能是( )
| A.a+8-m-n | B.a+16-m-n | C.a-m-n | D.a-8+m+n |
下列叙述正确的是
| A.反应物分子间的碰撞一定能发生化学反应 |
B.X(g)+2Y(g)  2Z(g) △H<0,反应达平衡后缩小容器体积,X浓度变小 2Z(g) △H<0,反应达平衡后缩小容器体积,X浓度变小 |
| C.反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H<0 |
D.反应2A(g)+ B(g) 3C(g)△H>0,在一定体积的密闭容器中达平衡后,加入B,反应的△H增大 3C(g)△H>0,在一定体积的密闭容器中达平衡后,加入B,反应的△H增大 |
已知1 g H2完全燃烧生成水蒸气放出热量121 kJ,且O2中1 mol O===O键完全断裂时吸收热量496 kJ,水蒸气中形成1 mol H—O键时放出热量463 kJ,则H2中1 mol H—H键断裂时吸收的热量为( )
| A.920 kJ | B.557 kJ | C.436 kJ | D.188 kJ |
反应NH4HS(s)  NH3(g)+H2S(g),在某一温度下达到平衡。下列各种情况中,不能使化学平衡发生移动的是
NH3(g)+H2S(g),在某一温度下达到平衡。下列各种情况中,不能使化学平衡发生移动的是
| A.其他条件不变时通入SO2气体 | B.移走一部分NH4HS固体 |
| C.容器体积不变,充入NH3 | D.压强不变时,充入N2 |
向绝热恒容密闭容器中通入SO2和NO2,在一定条件下使反应SO2(g)+NO2(g)  SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如下所示。由图可得出的正确结论是( )
SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如下所示。由图可得出的正确结论是( )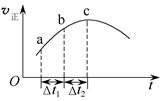
| A.反应在c点达到平衡状态 |
| B.反应物浓度:a点小于b点 |
| C.反应物的总能量低于生成物的总能量 |
| D.Δt1=Δt2时,SO2的转化率:a~b段小于b~c段 |
高温下2HBr(g) H2(g)+Br2(g) △H>0, 达到平衡时,要使混合气体颜色加深,可采取的方法
H2(g)+Br2(g) △H>0, 达到平衡时,要使混合气体颜色加深,可采取的方法
| A.降低温度 | B.缩小体积 | C.减小压强 | D.增大H2浓度 |