下列表述中正确的是 ( )
| A.NH4C1溶液因水解而显酸性,故NH4C1是弱电解质 |
B.纯碱溶液因水解而显碱性,水解的离子方程式为:CO32—+H2O H2CO3+2OH— H2CO3+2OH— |
C.可乐因含碳酸而显酸性,电离方程式为:H2CO3 CO32—+2H+ CO32—+2H+ |
| D.配制FeC13 溶液时,先将FeC13 溶于较浓的盐酸中,然后再加水稀释到所需浓度 |
短周期元素A、B、C、D的原子序数依次递增,它们的原子序数之和为36,原子最外层电子数之和为14。其中A与C同主族,B与D同主族,A、C原子的最外层电子数之和等于B原子的次外层电子数。下列叙述正确的是
A. 一定条件下,B单质能置换出D单质,C单质能置换出A单质
B. D元素处于元素周期表中第3周期第IVA族
C. A、C的最高价氧化物均为离子化合物
D. 四种元素的原子半径:A>B>D>C
在一固定容积的密闭容器中进行如下反应:2SO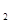 (g)+O
(g)+O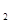 (g)
(g) 2SO
2SO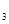 (g),已知反应进行到10秒时,SO
(g),已知反应进行到10秒时,SO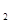 、O
、O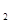 、SO
、SO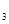 的物质的量分别为0.2 mol、0.1 mol、0.2 mol,则下列说法正确的是
的物质的量分别为0.2 mol、0.1 mol、0.2 mol,则下列说法正确的是
A.10秒时,用O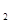 表示该反应的平均反应速率为0.01 mol/(L·s) 表示该反应的平均反应速率为0.01 mol/(L·s) |
B.当反应达平衡时,SO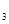 的物质的量可能为0.4 mol 的物质的量可能为0.4 mol |
C.当SO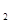 和O 和O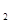 的生成速率之比为2:1时,达到该反应限度 的生成速率之比为2:1时,达到该反应限度 |
D.向容器内充人SO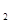 ,可以提高反应速率 ,可以提高反应速率 |
维生素A的结构简式如下图所示,关于它的叙述中正确的是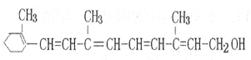
| A.维生素A属于烃 |
| B.维生素A不能与金属钠反应产生氢气 |
C.维生素A不能使酸性KMnO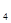 溶液褪色 溶液褪色 |
| D.维生素A能发生取代、加成、酯化反应 |
下列关于基本营养物质的叙述中,错误的是
| A.葡萄糖和果糖的分子式完全相同,它们互为同分异构体 |
| B.油脂在酸性条件下可以水解为甘油和高级脂肪酸,该反应称为皂化反应 |
| C.常温条件下,淀粉遇碘即可变蓝,该反应是淀粉的特征反应 |
| D.酶是一类特殊的蛋白质,是生物体内重要的催化剂 |
下列关于苯的叙述中错误的是
| A.苯在催化剂作用下能与液溴发生取代反应 |
B.在苯中加入酸性KMnO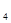 溶液,振荡并静置后下层液体为紫色 溶液,振荡并静置后下层液体为紫色 |
| C.在苯中加入溴水,振荡并静置后下层液体为橙色 |
| D.在一定条件下,苯能与氯气发生加成反应 |