某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如图所示的变化规律 (图中P表示压强,T表示温度,n表示物质的量,a表示物质的平衡转化率).根据以上规律判断,下列结论中正确的是 ( )
| A.反应Ⅰ:△H>0,p2>p1 | B.反应Ⅱ:△H>0,T1>T2 |
| C.反应Ⅰ:△H<0,p2>p1 | D.反应Ⅱ:△H>0,T2>T1 |
瘦肉精(Clenbuterol)是一种非常廉价的药品,对于减少脂肪增加瘦肉 (Lean Mass)作用非常好。瘦肉精让猪肉的单位经济价值提升不少,但它有很危险的副作用,轻则导致心律不整,严重一点就会导致心脏病。瘦肉精是白色或类白色的结晶粉末,其结构简式为: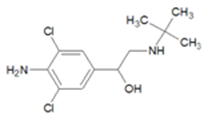
关于瘦肉精下列说法正确的是
| A.分子式为C12H18Cl2N2O | B.该有机物核磁共振氢谱有7种类型氢原子的吸收峰 |
| C.该有机物不能发生氧化反应 | D.该有机物所含官能团有羟基、氯原子、苯环 |
下列叙述中,错误的是
| A.离子化合物中可能含有非极性键 | B.分子晶体中的分子内不含有离子键 |
| C.原子晶体中可能含有非极性键 | D.分子晶体中的分子内一定有共价键 |
a、b、c、d是四种短周期元素。a、b、d同周期,c、d同主族。a的原子结构示意图为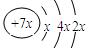 , b与c形成化合物的电子式为
, b与c形成化合物的电子式为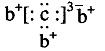 ;下列比较中正确的是
;下列比较中正确的是
A.原子半径:a >c>d>b >c>d>b |
B.电负性a>b>d>c |
| C.原子序数:d>a>c>b | D.最高价含氧酸的酸性c>d>a |
纳米材料的表面粒子数占总粒子数的比例极大,这是它具有许多特殊性质的原因。假设某氯化钠纳米颗粒的大小和形状恰好与氯化钠晶胞的大小和形状(如图所示)相同。则这种纳米颗粒的表面粒子数占总粒子数的百分数为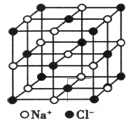
| A. 87.5% | B.92.9% | C.96.3% | D.100% |
能够证明甲烷构型是四面体的事实是
| A.甲烷的四个键键能相同 | B.甲烷的四个键键长相等 |
| C.甲烷的所有C-H键键角相等 | D.二氯甲烷没有同分异构体 |