下列关于化学反应速率的说法中错误的是( )
| A.反应速率用于衡量化学反应进行快慢 |
| B.决定化学反应速率的主要因素是反应物的本质 |
| C.可逆反应达到平衡状态时正逆反应的速率都为0 |
| D.增大反应物的浓度,提高反应温度都能增大反应速率 |
某同学为了探究沉淀的溶解平衡原理并测定某温度下PbI2的溶度积常数,设计了如下实验:I、取100mL蒸馏水,加入过量的PbI2固体(黄色),搅拌、静置,过滤到洁净的烧杯中,得到滤液a ;II、取少量滤液a于试管中,向其中加入几滴0.1mol/L的KI溶液,观察现象 ; III、另准确量取10.00 mL滤液,与离子交换树脂(RH)发生反应:2RH+Pb2+=R2Pb+2H+,交换完成后,流出液用中和滴定法测得n (H+)=3.000×10—5mol。分析过程,下列说法错误的是
| A.步骤I中搅拌的目的是使碘化铅充分溶解 |
| B.步骤II中观察到的现象是产生黄色沉淀 |
| C.此实验温度下,PbI2的溶度积常数Ksp=1.350×10-8 |
| D.若步骤I 盛装滤液的烧杯中有少量的水,Ksp的测定结果不受影响 |
N2O5是一种新型硝化剂,在一定温度下可发生 2N2O5(g)  4NO2 (g)+O2(g) ΔH>0
4NO2 (g)+O2(g) ΔH>0
T1温度时,向密闭容器中通入N2O5,部分实验数据见下表:
| 时间/s |
0 |
500 |
100 0 |
150 0 |
| c(N2O5)/ mol·L-1 |
5.00 |
3.52 |
2.50 |
2.50 |
下列说法中不正确的是
A.500 s 内N2O5分解速率为2.96×10—3 mol· L-1 · s-1
B.T1温度下的平衡常数为K1=125,平衡时N2O5的转化率为50%
C.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2
D.达平衡后其他条件不变,将容器的体积压缩到原来的1/2,则c(N2O5)>5.00 mol·L-1
25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是
| A.0.1mol/LCH3COONa与0.1mol/LHCl溶液等体积混合:c(Na+ )=c(Cl-)>c(CH3COO- )>c( H+ ) |
| B.0.1mol/LNH4Cl与0.1mol/L氨水等体积混合(pH>7):c(NH3·H2O)>c(NH4+ )>c(Cl-)>c(OH-) |
C.0.1mol/LNa2CO3与0.1mol/L NaHCO3溶液等体积混合: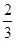 c (Na+ )=c(CO32-)+c(HCO3-)+c(H2CO3) c (Na+ )=c(CO32-)+c(HCO3-)+c(H2CO3) |
| D.0.1mol/LNa2C2O4与0.1mol/LHCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+ ) |
在一定温度下,体积不变的密闭容器中发生如下反应:CO2+H2 CO+H2O。已知在此条件下,3molCO2和1molH2充分反应达到平衡时,H2的转化率为75%。若在此条件下加入4 molCO2和1 mol H2,则达到平衡时CO和H2O的物质的量之和为
CO+H2O。已知在此条件下,3molCO2和1molH2充分反应达到平衡时,H2的转化率为75%。若在此条件下加入4 molCO2和1 mol H2,则达到平衡时CO和H2O的物质的量之和为
| A.1.5mol | B.1.6mol | C.1.8mol | D.2.5mol |
NH4Cl稀溶液中分别加入少量下列物质或改变如下条件,能使比值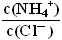 一定增大的是①HCl气体②氨气(NH3)③H2O④NH4Cl固体⑤NaOH固体⑥降温
一定增大的是①HCl气体②氨气(NH3)③H2O④NH4Cl固体⑤NaOH固体⑥降温
| A.③④⑤ | B.②④ | C.②③⑥ | D.②④⑥ |