某同学做同周期元素性质递变规律实验时,设计了一套实验方案,并记录了有关实验现象(见下表,表中左右的“实验方案”与“实验现象”不一定是对应关系)。
| 实验方案 |
实验现象 |
| ①镁条除去氧化膜后,放入试管中,加入少量水,加热至沸腾;再向溶液中滴加酚酞溶液 |
A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变红色 |
| ②向新制得的Na2S溶液中滴加新制的氯水 |
B.有气体产生,溶液变成浅红色 |
| ③将小块金属钠放入滴有酚酞溶液的冷水中 |
C.剧烈反应,迅速产生大量无色气体 |
| ④将除去氧化膜的镁条投入稀盐酸中 |
D.反应不十分剧烈,产生无色气体 |
| ⑤将除去氧化膜的铝条投入稀盐酸中 |
E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向A1Cl3溶液中滴加NaOH溶液至过量 |
F.生成淡黄色沉淀 |
请你帮助该同学整理并完成实验报告。
(1)实验目的:研究第3周期元素性质的递变规律。
(2)实验用品:
试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液,AlCl3溶液,NaOH
溶液,酚酞溶液等。
仪器:砂纸,试管,试管夹,① ,火柴,胶头滴管,烧杯,镊子,小刀,玻璃片,
② 等。
(3)实验内容:
| 实验方案 |
② |
④ |
⑥ |
| 实验现象(填A~F) |
|
|
|
①的化学方程式 ,
②的离子方程式 。
(4)实验结论: 。
(15分)铝铁合金在微电机中有广泛应用,某兴趣小组为利用废弃的铝铁合金设计了如下实验流程制备聚合硫酸铁和明矾:
(1)聚合硫酸铁是一种无毒无害、化学性质稳定、能与水混溶的新型絮凝剂,微溶于乙醇,其化学式可表示为[Fe2(OH)x(SO4)y]n。
①聚合硫酸铁可用于净水的原理是。
②有人认为上述流程中的“氧化”设计存在缺陷,请提出改进意见:;浓缩时向其中加入一定量的乙醇,加入乙醇的目的是。
③加入试剂Y的目的是调节pH,所加试剂Y为;溶液的pH对[Fe2(OH)x(SO4)y]n中x的值有较大影响(如图1所示),试分析pH过小(pH<3)导致聚合硫酸铁中x的值减小的原因:。
(2)明矾是一种常见铝钾硫酸盐。
①为充分利用原料, 试剂X应为。
②请结合图2所示的明矾溶解度曲线,补充完整由滤液Ⅰ制备明矾晶体的实验步骤(可选用的试剂:废弃的铝铁合金、稀硫酸、NaOH溶液和酒精):向滤液Ⅰ中加入足量的含铝废铁屑至不再有气泡产生,,得到明矾晶体。
(12分) ZrO2常用作陶瓷材料,可由锆英砂(主要成分为ZrSiO4,也可表示为ZrO2·SiO2,还含少量Fe2O3、Al2O3、SiO2等杂质)通过如下方法制取。
已知:①ZrO2能与烧碱反应生成可溶于水的Na2ZrO3,Na2ZrO3与酸反应生成ZrO2+。
②部分金属离子在实验条件下开始沉淀和完全沉淀的pH如下表。
| 金属离子 |
Fe3+ |
Al3+ |
ZrO2+ |
| 开始沉淀时pH |
1.9 |
3.3 |
6.2 |
| 沉淀完全时pH |
3.2 |
5.2 |
8.0 |
(1)熔融时ZrSiO4发生反应的化学方程式为,滤渣I的化学式为。
(2)为使滤液I的杂质离子沉淀完全,需用氨水调pH=a,则a的范围是;继续加氨水至pH=b时,所发生反应的离子方程式为。
(3)向过滤III所得滤液中加入CaCO3粉末并加热,得到两种气体。该反应的离子方程式为。
(4)为得到纯净的ZrO2,Zr(OH)4需要洗涤,检验Zr(OH)4是否洗涤干净的方法是。
B.[实验化学]茶叶中含咖啡碱,能溶于水、乙醇,更易溶于氯仿(CHCl3),178℃时快速升华。另外茶叶中还含有11% ~12%的丹宁酸,也易升华,易溶于水及乙醇,但不溶于氯仿。现从茶叶中提取咖啡碱流程如下:
步骤I:称取一定量的茶叶,放入下图所示提取器的滤纸筒中,在圆底烧瓶中加入95%乙醇,用水浴加热,连续提取1.5小时。
步骤Ⅱ:待冷凝液刚刚虹吸下去时,立即停止加热。稍冷后,改成蒸馏装置,回收提取液中的大部分乙醇。
步骤Ⅲ:趁热将瓶中的残液倾入蒸发皿中,拌入3 ~ 4g生石灰粉使成糊状,低温蒸干,并压碎块状物。
步骤Ⅳ:取一只口径合适的玻璃漏斗,罩在隔以刺有许多小孔滤纸的蒸发皿上,小心加热升华,控制温度在180℃左右。当滤纸上出现大量白色毛状结晶时,停止加热,使其自然冷却,收集升华所得咖啡因。
回答下列问题:
(1)实验之前需要将茶叶研磨成粉末状,其目的是。
(2)溶解抽提时不选择氯仿直接将咖啡碱提取而选用乙醇的原因是。
(3)提取器中虹吸管的作用是。
(4)冷凝器中冷却水从进出(选填“a”或“b”)。
(5)生产过程中可循环使用的物质是。
(6)在粗产品中加入生石灰的原因是。
(15分)乙酰苯胺具有解热镇痛作用,是较早使用的解热镇痛药,有“退热冰”之称,其制备原理如下: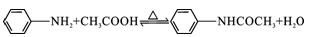
已知:
①苯胺易被氧化。
②乙酰苯胺、苯胺和醋酸的部分物理性质如下表:
| 物质 |
熔点 |
沸点 |
溶解度 |
| 乙酰苯胺 |
114.3℃ |
305℃ |
微溶于冷水、易溶于热水 |
| 苯胺 |
-6℃ |
184.4℃ |
微溶于水 |
| 醋酸 |
16.6℃ |
118℃ |
易溶于水 |
实验步骤如下: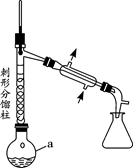
步骤1:在a中,加入9mL (0.10 mol)苯胺、15 mL(0.27 mol)冰醋酸及少许锌粉,依照上图装置组装仪器。
步骤2:控制温度计读数在105℃左右,小火加热回流至反应完全。
步骤3:趁热将反应混合物倒入盛有100 mL 冷水的烧杯中,冷却后抽滤(一种快速过滤方法)、洗涤,得到粗产品。
步骤4:将步骤3所得粗产品进一步提纯后,称得产品质量为10.8g。
请回答下列问题:
(1)仪器a的名称为,所选仪器a的最佳规格是(填序号)。
A.25 mLB.50 mL C.100 mLD.250 mL
(2)实验中加入少许锌粉的目的是。
(3)步骤2中,控制温度计读数在105℃左右的原因是。
(4)判断反应已基本完全的方法为。
(5)步骤3中趁热将混合物倒入盛有冷水的烧杯中,“趁热”的原因是。
(6)步骤4中粗产品进一步提纯,该提纯方法是。
(7)本次实验的产率为。
实验室以苯、乙醛为原料,三氯化铝为催化剂来制备1,1—二苯乙烷,其反应原理为: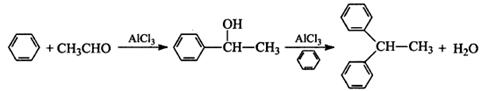
制备过程中其他产物会与AlCl3发生副反应。主要实验装置和步骤如下: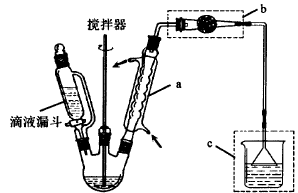
I.合成:
在250 mL三口烧瓶中加入140mL苯(密度0.88g/mL)、19gA1C13和5.5g乙醛,在20℃时充分反应。
Ⅱ.分离与提纯:
将反应混合物倒入装有150 mL,冰水和少量盐酸的烧杯中,充分搅拌,用分液漏斗分离出有机层,依次用水、2%碳酸钠溶液、水洗涤,在分离出的粗产品中加入少量无水硫酸镁固体,过滤后先常压蒸馏除去过量苯再改用减压蒸馏收集170~172℃/6.67kPa的馏分,得12.5g 1,l—二苯乙烷。
(1)仪器a的名称:;其他产物与A1C13发生副反应的化学方程式为:;装置C的作用:。
(2)连接装置b的作用是。
(3)在洗涤操作中,第二次水洗的主要目的是 。实验中加入少量无水硫酸镁的目的是。
(4)粗产品常压蒸馏提纯时,下列装置中温度计位置正确的是,可能会导致收集到的产品中混有低沸点杂质的装置是。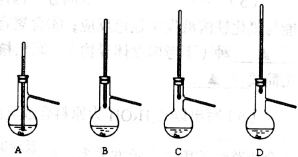
(5)本实验所得到的1,1—二苯乙烷产率约为(填正确答案的序号)。
| A.41% | B.48% | C.55% | D.65% |