几位同学设计实验观察铜与浓硫酸的反应,检验生成的气体的性质。甲设计了如图所示的装置,在大试管里加入2mL浓硫酸,用带导管和一个小孔的胶管塞紧,从孔中插入一根铜丝,加热,把产生的气体依次通入品红溶液和石蕊溶液中。
请回答下列问题:
(1)写出铜与浓硫酸反应的化学方程式: 。
(2)试管b中的现象是 ,
通过试管a、b的现象得出的结论是 。
(3)乙同学认为甲同学的设计不能全面体现SO2的性质,他打算增加试管进行其它实验。以下为增加的试管中盛放的试剂:A. 澄清石灰水 B. KMnO4(aq) C. 氢硫酸
请你帮助乙同学作出选择,在横线上先写出字母,再用文字简单说明实验的目的。
(4)丙同学评价甲同学的实验装置既有优点也有不足,优点是
,不足之处改进的具体措施是 。
(5)若把上述装置中大试管的浓硫酸换成稀硝酸,试管a和b作如下改变(其中a装满水,b空置),则在大试管中发生的反应的离子方程式为 ,
试管a的作用是 。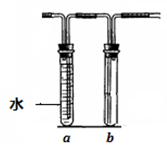
某研究性学习小组拟从海带处理后的含碘废水中进行回收碘,制订两种方案提取,其实验方案如下,试回答以下问题:
(1)方案一中步骤②的化学反应方程式 ▲。
(2)方案二中用H2O2溶液而不用氯气,其理由是 ▲。
(3)方案二中步骤⑥的名称是 ▲。
(4)步骤⑦用到的仪器,除酒精灯、三脚架、蒸发皿、坩锅钳、滤纸、火柴等外,还缺少的玻璃仪器有 ▲(填两种)。
(12分)实验室用加热l-丁醇、溴化钠和浓H2SO4的混合物的方法来制备1-溴丁烷时,还会有烯、醚等副产物生成。反应结束后将反应混合物蒸馏,分离得到1—溴丁烷,已知相关有机物的性质如下:
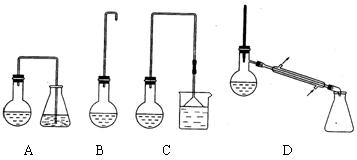
⑴制备1-溴丁烷的装置应选用上图中的_______(填序号)。反应加热时的温度不宜超过
100℃,理由是_________________________。
⑵制备操作中,加入的浓硫酸必需进行稀释,其目的是。(填字母)
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发d.水是反应的催化剂。
⑶反应结束后,将反应混合物中1-溴丁烷分离出来,应选用的装置是______。该操作应控制的温度(t)范围是_______________。
⑷欲除去溴代烷中的少量杂质Br2,下列物质中最适合的是。(填字母)
a.NaI b.NaOH c.NaHSO3 d.KCl
某化学兴趣小组为了探究锌与浓硫酸反应生成气体的成分做了如下实验:
将50g锌粉与50mL浓H2SO4在加热条件下充分反应,锌粉有剩余,收集到一定体积的气
体,将该气体体积折算成标准状况为11.2L。
(1)化学兴趣小组所制得的气体X中混有的主要杂质气体可能是__________,产生这种结果的主要原因是(用离子方程式表示)_________________ 。
(2)实验验证:为了检验主要杂质气体的成分,化学兴趣小组的同学设计了如下实验,对气体X取样进行探究。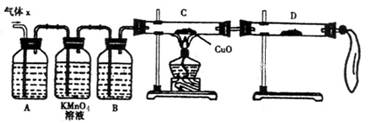
①A中加入的试剂可能是__________,B中加入的试剂可能是_________。
②观察到C中的实验现象是____________________,D中最好选择的试剂是________。
(3)理论分析:若该小组同学收集到气体的质量为25.8g,所用浓硫酸的物质的量浓度为18.0mol/L。则通过计算确定气体X中各成分物质的量分别为_____________。
为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42+以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):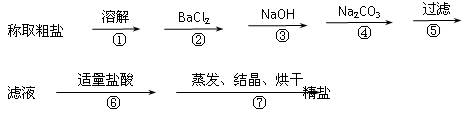
(1)判断BaCl2已过量的方法是_________________________。
(2)第④步中,相关的离子方程式是___________;。
(3)若先用盐酸调pH值再过滤,将对实验结果产生影响,其原因是_____________。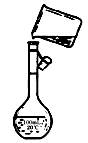
(4)为检验精盐纯度,需配制150 mL.0.2 mol/L NaCl(精盐)溶液,上图是该同学转移溶液的示意图,图中的错误是__________。
实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏(如下图所示),得到含有乙醇、乙酸和水的乙酸乙酯粗产品。请回答下列问题:
(已知:乙醇、乙酸、乙酸乙酯的沸点依次是78.4℃、118℃、77.1℃)
(1)在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入几块碎瓷片,其目的_____________。
(2)配制乙醇和浓硫酸的混合液的方法是:先在烧瓶中加入一定量的,然后慢慢将加入烧瓶,边加边振荡。
(3)在该实验中,若用1 mol乙醇和1 mol 乙酸在浓硫
作用下加热,充分反应,不能生成1 mol乙酸乙酯的原因是
。
(4)锥形瓶中得到乙酸、乙醇和水的乙酸乙酯的混合物,欲得到乙酸乙酯并闻到它的气味,需将混合液用溶液处理,用
(填仪器)分离。