向8 g二价金属的氧化物固体中加入稀H2SO4,使其恰好完全溶解,已知所消耗的硫酸体积为100 mL,在所得溶液中插入铂电极进行电解,通电一段时间后,在一个电极上收集到224 mL(标准状况)氧气,在另一个电极上析出该金属1.28 g。
(1)根据计算确定金属氧化物的名称。
(2)计算通电后硫酸溶液的物质的量浓度(假设溶液体积不变)。
(14分)为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物和硫氧化物含量显得尤为重要。
(1)汽车内燃机工作时会引起N2和O2的反应:N2 + O2 2NO,是导致汽车尾气中含有NO的原因之一。
2NO,是导致汽车尾气中含有NO的原因之一。
①在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如右图所示,根据图像判断反应N2(g) + O2(g) 2NO(g)的△H________0(填“>”或“<”)。
2NO(g)的△H________0(填“>”或“<”)。
②在T3温度下,向2L密闭容器中充入10molN2与5mo1O2,50秒后达到平衡,测得NO的物质的量为2mol,则该反应的速率υ(N2)=___________________。该温度下,若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后N2的转化率为____________。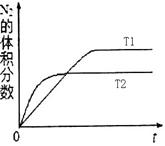
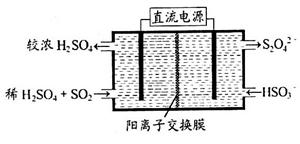
(2)利用右图所示装置(电极均为惰性电极)可吸收SO2,用阴极排出的溶液可吸收NO2。
①阳极的电极反应式为_____________________。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成。该反应中氧化剂与还原剂的物质的量之比为________。
(3)一定条件下可用甲醇与CO反应生成醋酸消除CO污染。常温下,将a mol/L的醋酸与b mol/L
Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=______________________(用含a和b的代数式表示)。
(4)引起雾霾的PM2.5微细粒子包含(NH4)2SO4、NH4NO3、有机颗粒物及扬尘等,任写一种与SO42-互为等电子体的分子。
(本题共15分)
有4种质量比可能相同或不同的镁铝合金样品①、②、③、④。甲、乙、丙、丁4位同学各取1种样品,进行下列实验,测定合金中镁的质量分数。
52.甲同学取样品①m1g和过量的氢氧化钠溶液反应,然后过滤;再往滤液中通入过量的二氧化碳气体,将所得沉淀过滤、洗涤、烘干、灼烧,得到固体质量仍为m1g。则样品①合金中镁的质量分数为_____________。
53.乙同学取样品②m2g和足量的盐酸反应,然后滴加过量的氢氧化钠溶液,将沉淀过滤、洗涤、烘干、灼烧,得到固体质量仍为m2g。则样品②合金中镁的质量分数为____________。
54.丙同学取样品③m3g和足量的稀硫酸反应,发现固体完全溶解,标准状况下得到气体体积为V L,则样品③中m3的取值范围是___________________________________________。
丁同学取不同质量的样品④分别和30 mL同浓度的盐酸反应,所取合金质量与产生气体体积(已转化为标准状况)如下:
| 实验序号 |
a |
b |
c |
| 合金质量/mg |
510 |
765 |
918 |
| 气体体积/mL |
560 |
672 |
672 |
55.通过计算求该盐酸的物质的量浓度。
56.通过计算求样品④中合金中镁的质量分数。
57.在c组实验后,还需向容器中加入1.0 mol·L-1的氢氧化钠溶液多少毫升才能使剩余合金中的铝恰好完全溶解?
1.76克铜镁合金完全溶解于50mL、密度为1.40g/cm3、质量分数为63%的浓硝酸中,得到NO2气体1792mL (标准状况),向反应后的溶液中加入适量的1.0mol/LNaOH溶液,恰使溶液中的金属离子全部沉淀。下列说法不正确的是
| A.该浓硝酸中HNO3的物质的量浓度是14.0mol/L |
| B.加入NaOH溶液的体积是50mL |
| C.浓硝酸在与合金反应中起了酸性和氧化性的双重作用,且起氧化性的硝酸的物质的量为0.08mol |
| D.得到的金属氢氧化物的沉淀为3.12克 |
向质量为m的 20%的氢氧化钠溶液中逐滴加入硫酸镁溶液,至恰好完全反应时,滤去沉淀,称量所得滤液总质量为3m 。
(1)计算生成Mg(OH)2沉淀的质量(用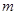 表示);
表示);
(2)计算所加硫酸镁溶液中溶质的质量分数(最后结果精确到0.1%)。
(18分)Heck反应是合成C--C键的有效方法之一,如反应
化合物II可由以F合成路线获得:
(1) Heck反应的反应类型是____反应;V→II的反应类型是_________反应
(2)化合物III的分子式为___________,1 mol化合物III最多可与_______mol H2发生加成反应。
(3)若化合物IV分子结构中有甲基,写出由化合物IV反应生成化合物V的化学方程式 ________________________________________________________.
(4)有关化合物II说法正确的是________________
| A.l mol化合物II完全燃烧消耗5 mol O2 |
| B.化合物II能使酸性高锰酸钾溶液褪色 |
| C.化合物II难溶于水 |
D.化合物II分子间聚合,反应生成的高聚物结构为 |
(5)化合物III的一种同分异构体VI,苯环上的一氯取代物有两种,VI能与NaHCO3溶液反应生成无色气体,除苯环上的氢外核磁共振氢谱还有四组峰,峰面积之比为1:1:1:3,VI的结构简式为_______________________________.
(6)  也可以发生类似反应①的反应,反应后有机产物的
也可以发生类似反应①的反应,反应后有机产物的
结构简式为_________________________________.