在2A+B 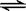 3C+4D中,表示该反应速率最快的是
3C+4D中,表示该反应速率最快的是
A.υ(A) = 0.5mol/(L·s) B.υ(B) =" 0.3" mol/(L·s)
C.υ(C) = 0.8mol/(L·s) D.υ(D)=" 1" mol/(L·s)
利用如图装置,完成很多电化学实验。下列有关此装置的叙述中,不正确的是( )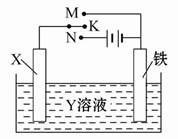
| A.若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为牺牲阳极的阴极保护法 |
| B.若X为碳棒,Y为NaCl溶液,开关K置于N处,可减缓铁的腐蚀 |
| C.若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铜电极移动 |
| D.若X为铜棒,Y为硫酸铜溶液,开关K置于N处,铁棒质量将增加,溶液中铜离子浓度将减小 |
将镁条、铝条平行插入盛有一定浓度的NaOH溶液的烧杯中,用导线和电流表连接成原电池,装置如图所示。此电池工作时,下列叙述正确的是( )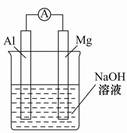
| A.Mg比Al活泼,Mg失去电子被氧化成Mg2+ |
| B.铝条表面虽有氧化膜,但可不必处理 |
| C.该电池的内外电路中,电流均是由电子定向移动形成的 |
| D.Al是电池负极,开始工作时溶液中会立即有白色沉淀析出 |
关于下列各装置图的叙述中,不正确的是( )
| A.用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液 |
| B.装置②的总反应式是Cu+2Fe3+=Cu2++2Fe2+ |
| C.装置③中钢闸门应与外接电源的负极相连 |
| D.装置④中的铁钉几乎没被腐蚀 |
串联电路中四个电解池分别装有0.5 mol·L-1的下列溶液,用惰性电极电解,连接直流电源一段时间后,溶液pH最小的是( )
| A.KNO3溶液 | B.NaCl溶液 | C.AgNO3溶液 | D.CuCl2溶液 |
如图是某固体酸燃料电池基本结构示意图,其中以Ca(HSO4)2固体为电解质传递H+,电池总反应式为:2H2+O2=2H2O,下列有关说法不正确的是( )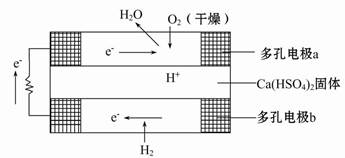
| A.H2通过多孔电极时能增大H2的接触面积,加快反应 |
| B.a极上的电极反应式为:O2+2H2O+4e-=4OH- |
| C.每转移0.1 mol电子,消耗标准状况下的H2 1.12 L |
| D.H+由b极通过固体酸电解质传递到a极 |