工业上采用乙烯和水蒸气在催化剂(磷酸/硅藻土)表面合成乙醇,反应原理为:
CH2=CH2(g)+ H2O(g) CH3CH2OH(g)△H <0,达到平衡时,要使反应速率加快,同时乙烯的转化率提高,应采取的措施是
CH3CH2OH(g)△H <0,达到平衡时,要使反应速率加快,同时乙烯的转化率提高,应采取的措施是
| A.减小压强 | B.增大压强 | C.分离除乙醇 | D.升高温度 |
已知0.1mol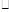 L-1的二元酸H2A溶液的pH=4.0则下列说法中正确的是
L-1的二元酸H2A溶液的pH=4.0则下列说法中正确的是
A.在Na2A、NaHA两溶液中,离子种类不相同
B.在溶质物质的量相等的Na2A、NaHA两溶液中有:2c(Na+)=3c(A2-)+3c(HA-)+3c(HA)
C.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-)
D.在Na2A溶液中一定有:c(Na+)>c(A2-)>c(H+)>c(OH-)
下列化学实验事实及其解释都正确的是
| A.将蔗糖和稀硫酸混合加热后,再加入银氨溶液并水浴加热,以检验还原性糖 |
| B.分离苯和苯酚的混合液,因三溴苯酚不溶于水,所以可先加入适量浓溴水,再过滤、分液即可实现 |
| C.向碘水中滴加CCl4,振荡静置,CCl4层呈紫红色,说明可用CCl4从碘水中萃取碘 |
| D.将SO2通入盐酸酸化的Ba(NO3)2溶液,有白色沉淀生成,说明BaSO3难溶于盐酸 |
短周期元素X、Y、Z、W、Q在元素周期表中的位置如图所示。下列说法正确的是
| A.元素W的最高价氧化物对应的水化物的酸性比Q的强 |
| B.原子半径的大小顺序为:X>Y>Z>W>Q |
| C.离子Y2-和Z3+的核外电子数和电子层数都不相同 |
| D.元素Y与元素W的最高化合价的数值等于其族序数 |
关于下列各装置图的叙述中,不正确的是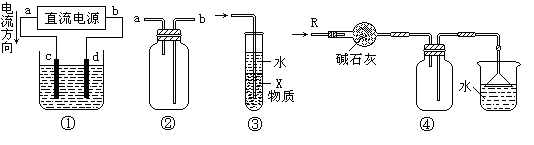
| A.装置①中,d为阳极、c为阴极 |
| B.装置②可用于收集H2、NH3、CO2、Cl2、NO2等气体 |
| C.装置③中X若为四氯化碳,可用于吸收氨气,并防止倒吸 |
| D.装置④可用于干燥、收集氨气,并吸收多余的氨气 |
下列关于溶液和胶体的叙述,不正确的是
| A.“海市蜃楼”既是—种自然现象又是光学现象,也与胶体的知识有关 |
| B.欲制备Fe(OH)3腔体,将Fe(OH)3溶于水,搅拌即可 |
| C.利用渗析法可以分离除去淀粉溶液中的Na+和Cl- |
| D.一束光线分别通过溶液和胶体时,后者会出现明显的光带,前肯则没有 |