实验制取乙烯时,应将乙醇和浓硫酸快速加热到170℃,在140℃时会生成乙醚,温度过高会使部分乙醇跟浓H2SO4反应生成SO2、CO2、水蒸气。
(1)分别写出乙醇跟浓H2SO4反应生成①脱水生成CH2=CH2;②分子间脱水生成CH3CH2-O-CH2CH3;③SO2、CO2、水蒸气的化学方程式
① ;
② ;
③ ;
(2)二氧化硫是大气污染物之一,空
气中的二氧化硫随雨水下降形成酸雨。如下图实验装置,对酸雨的形成进行模拟并验证二氧化硫的部分性质,请回答:
①指出图中仪器a的名称: 。
②B装置中淡红色纸花的颜色逐渐变褪去,说明SO2有 性。
③反应结束后取出C装置中少量液体,滴加紫色石蕊试液后变 色。
④实验完毕后。为了使多余的二氧化硫被充分吸收,C装置应如何改进?
(用文字说明) 。
二氯化二硫(S2Cl2)在工业上用于橡胶的硫化。为在实验室合成S2Cl2,某化学研究性学习小组查阅了有关资料,得到如下信息:
①将干燥的氯气在110 ℃~140 ℃与硫反应,即可得S2Cl2粗品。
②有关物质的部分性质如下表:
| 物质 |
熔点/℃ |
沸点/℃ |
化学性质 |
| S |
112.8 |
444.6 |
略 |
| S2Cl2 |
-77 |
137 |
遇水生成HCl、SO2、S;300 ℃以上完全分解: S2Cl2  S+SCl2 S+SCl2 |
设计实验装置图如下: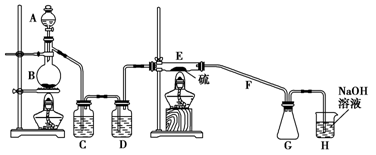
(1)上图中气体发生和尾气处理装置不够完善,请你提出改进意见。
利用改进后的正确装置进行实验,请回答下列问题:
(2)B中反应的离子方程式:;E中反应的化学方程式:。
(3)C、D中的试剂分别是、。
(4)仪器B的名称是,F的作用是。
(5)如果在加热E时温度过高,F中可能出现的现象是
(6)S2Cl2粗品中可能混有的杂质是(填写两种),为了提高S2Cl2的纯度,关键的操作是控制好温度和。
制印刷电路的废液含有大量CuCl2、FeCl2和FeCl3,测得某废腐蚀液中含CuCl21.5 mol·L-1、FeCl2 3.0 mol·L-1、FeCl3 1.0 mol·L-1、HCl 3.0 mol·L-1。取废腐蚀液200 mL按如下流程在实验室进行实验,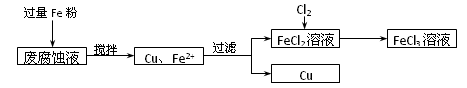
回答下列问题:
(1)用上述方法获得的铜粉中含有杂质,除杂所需试剂是__________;检验废腐蚀液中含有存在Fe2+的方法是______________________(注明试剂、现象)。
(2)实验室可用浓盐酸和固体MnO2反应制备Cl2。此反应中体现了盐酸的_________性质,反应的离子方程式为____________________。
利用图1制备Cl2并通入到FeCl2溶液中获得FeCl3溶液。请从图2中挑选所需的仪器,完成图1中的装置简图(可添加必要的塞子、玻璃导管、胶皮管。不画固定装置),并标明容器中所装试剂名称。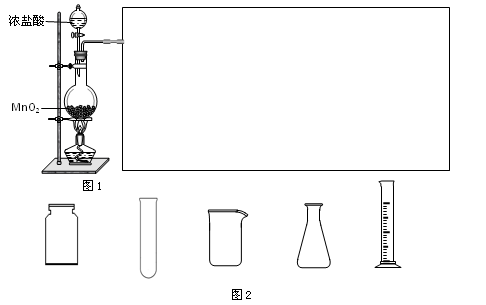
(3)按上述流程操作,需称取Fe粉的质量应不少于_____________g,需通入Cl2的物质的量不少于_______________mol。
一般情况下,当人体一次性摄取300 mg~500 mg亚硝酸钠时,就会引起中毒.某研究小组用碘量法测定泡菜中亚硝酸盐的含量.有关反应如下:
2NaNO2+2H2SO4+2KI===2NO↑+I2+K2SO4+Na2SO4+2H2O
2Na2S2O3+I2===Na2S4O6+2NaI
取1 kg泡菜,榨汁,将榨出的液体收集后,加入提取剂和氢氧化钠,使泡菜汁中的亚硝酸盐都成为亚硝酸钠.在过滤后的滤液中加入氢氧化铝乳液,以除去色素.再次过滤后得到滤液,将该滤液稀释至1 L,取25.00 mL稀释后的滤液与过量的稀硫酸和碘化钾溶液反应,再选用合适的指示剂,用0.05000 mol·L-1Na2S2O3标准溶液进行滴定.实验数据记录如下:
| 滴定次数 |
0.050 00 mol·L-1 Na2S2O3标准溶液体积/mL |
|
| 滴定前刻度 |
滴定后刻度 |
|
| 1 |
0.00 |
20.04 |
| 2 |
0.12 |
20.08 |
| 3 |
0.05 |
20.05 |
请回答下列问题:
(1)该实验中可选用的指示剂是________,滴定终点的现象是________.
(2)有经验的厨师在做泡菜时往往加入适量的橙汁,以减轻亚硝酸盐的危害.这主要是因为橙汁中含有丰富的维生素C,维生素C具有________性(填“氧化”或“还原”).
(3)通过计算判断若某人一次食入0.125 kg这种泡菜,是否会引起中毒?
________________________________________________________________________
________________________________________________________________________
请设计实验方案,用以证明某淀粉溶液,
①正在水解,②完全没有水解,③已经水解完全。
(12分)今年5月我区举行实验技能考查,某兴趣小组的同学在帮助老师准备化学实验时,发现实验台上整齐摆放的药品中(见下图),有一试剂瓶的标签破损。为了鉴定该试剂成分,同学们做了以下探究:
【提出问题】这瓶试剂的成分是什么?
[讨论]根据受损标签及实验室药品分类摆放的原则,这瓶试剂可能不是_______________________;
A.酸 B.碱 C.盐
[猜想]①可能是NaOH溶液;②可能是Na2CO3溶液;
③可能是_______________________(写一种)。
[探究活动]
(1)小军取少量试样于小试管中,滴加酚酞试液,溶液变为红色。由此小军认为猜想①正确。
经同学们交流讨论后,一致认为小军的方案不可行,理由是_______________________
(2)小华同学认为,虽然小军的实验不能得到正确的结论,但只要再往溶液中滴加一种氯化
物溶液,同样能得出正确的结论。
| 操作步骤 |
实验现象 |
实验结论 |
| 取少量滴有酚酞试液的试样于小试管中,滴加足量的___________ |
溶液由红色褪为无色 且有白色沉淀产生 |
猜想②正确 |
(3)小亮发现要进一步确定(1)中的成分,只需选择上图已有的试剂就能把它鉴定出来。于是他们进行了如下实验。
| 操作步骤 |
实验现象 |
结论及化学方程式 |
| 取少量试样于小试管中,滴加适量的_______________________ |
_________________ _________________ |
猜想②正确 有关化学方程式 _________________ |
[实验反思]实验室盛放NaOH溶液的试剂瓶不能用玻璃塞,其原因是:NaOH与玻璃中的
SiO2发生反应,其化学方程式为2NaOH + SiO2=" X" + H2O,产物X使瓶口与塞子粘合在一起。
试推测X的化学式为_________________。