下列叙述中正确的是
| A.实验室存放HF的溶液,不能用带玻璃塞的细口瓶,而应用带橡胶塞的细口瓶。 |
| B.碳酸氢镁溶液中加过量澄清石灰水的离子方程式为: Ca2+ +Mg2++2OH- +2HCO3- =MgCO3↓+CaCO3↓+2H2O |
| C.水泥、玻璃和水晶都是硅酸盐产品 |
| D.喝补铁剂时,加服维生素C,效果更好,原因是维生素C具有还原性 |
E.向新制的饱和氯水中分别加入CaCO3固体和Na2CO3固体,均会使得HClO的浓度增大
F.配制硫酸亚铁溶液时,为防止产生Fe3+,可在溶液中加入少量铁粉,为了抑制亚铁离子的水解,可在溶液中加入少量盐酸
G.无色溶液中,K+、Cl-、Na+、H2PO、PO、SO可以大量共存
H.由水电离的c(H+)=10-12mol/L的溶液中,ClO-、HCO、NO、NH、S2O可以大量共存
I.合金中一定有金属元素,两种不同的金属不一定可以加工成合金
J.某无色溶液含有下列离子中的若干种:H+、NH4+、Fe3+、Ba2+、Al3+、CO32–、Cl–、OH–、NO3–。向该溶液中加入铝粉,只放出H2,则溶液中能大量存在的离子最多有5种
标准状况下,将a L H2和Cl2的混合气体点燃,充分反应后,将混合气体通入含b mol NaOH的热溶液中,气体恰好被完全吸收,NaOH无剩余,测得反应后溶液中含Cl-、ClO-、ClO,且三者物质的量之比为8∶1∶1,则原混合气体中H2的物质的量为()
| A.a/2 mol |
| B.(a/22.4-b)mol |
| C.(a/22.4-b/2)mol |
| D.b/2 mol |
已知A、B为单质,C为化合物。则下列说法正确的是()
A+B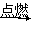 C
C C溶液
C溶液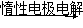 A+B
A+B
①若C溶于水后得到强碱溶液,则A可能是Na
②若C溶液遇Na2CO3放出CO2气体,则A可能是H2
③若C溶液中滴加KSCN溶液显血红色,则B可能为Fe
④若C溶液中滴加NaOH溶液有蓝色沉淀生成,则B可能为Cu
A.①② B.③④C.①③D.②④
A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X。它们有如下的转化关系(部分产物及反应条件已略去),下列判断正确的是()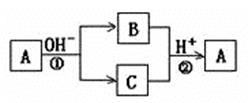
A.X元素可能为Al
B.X元素一定为非金属元素
C.反应①和②互为可逆反应
D.反应①和②不一定为氧化还原反应
根据表中信息判断,下列选项不正确的是()
| 序号 |
反应物 |
产物 |
| ① |
KMnO4 、H2O2 、H2SO4 |
K2SO4 、MnSO4...... |
| ② |
Cl2 、FeBr2 |
FeCl3、FeBr3 |
| ③ |
MnO4- ...... |
Cl2 、Mn2+ ...... |
A.第①组反应的其余产物为H2O和 O2
B.第②组反应中Cl2 与 FeBr2的物质的量之比为1︰1
C.第③组反应中生成1mol Cl2,转移电子2mol
D.氧化性由强到弱顺序为MnO4- > Cl2 > Br2 > Fe3+