按照原子核外电子排布规律:各电子层最多容纳的电子数为2n2(n为电子层数,其中,最外层电子数不超过8个,次外层不超过18个)。1999年已发现了核电荷数为118的元素,其原子核外电子层排布是( )
| A.2,8,18,32,32,18,8 | B.2,8,18,32,50,8 |
| C.2,8,18,32,18,8 | D.2,8,18,32,50,18,8 |
已知:①1 mol H2分子中化学键断裂时需要吸收436 kJ的能量②1 mol Cl2分子中化学键断裂时需要吸收243 kJ的能量③由H原子和Cl原子形成1 mol HCl分子时释放431 kJ的能量
下列叙述正确的是
| A.氢气和氯气反应生成氯化氢气体的热化学方程式是 H2(g)+Cl2(g) = 2HCl(g) |
| B.氢气和氯气反应生成2 mol氯化氢气体,反应的DH =" 183" kJ/mol |
| C.氢气和氯气反应生成2 mol氯化氢气体,反应的DH =-183 kJ/mol |
| D.氢气和氯气反应生成1 mol氯化氢气体,反应的DH =-183 kJ/mol |
有一电解池中X,Y分别是直流电源的两极,通电后发现a极(连X)板质量增加,b极(连Y)板处有无色无臭气体放出,符合这一情况的是附表中的
附表可供选择的极板、电极和溶液组
| 组合 |
a极板 |
b极板 |
X电极 |
Z溶液 |
| A |
锌 |
石墨 |
负极 |
CuSO4 |
| B |
石墨 |
石墨 |
负极 |
NaOH |
| C |
银 |
铁 |
正极 |
AgNO3 |
| D |
铜 |
石墨 |
负极 |
CuCl2 |
铁和足量的稀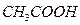 反应时,加入少量
反应时,加入少量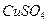 固体,下列叙述正确的是
固体,下列叙述正确的是
A.反应速率减慢,产生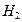 的量不变 的量不变 |
B.反应速率加快,产生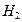 的量不变 的量不变 |
C.反应速率不变,产生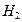 的量增加 的量增加 |
D.反应速率加快,产生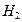 的量减少 的量减少 |
已知充分燃烧a g乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量Q kJ,则乙炔燃烧的热化学方程式正确的是
| A.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=-2Q kJ·mol-1 |
| B.C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l);ΔH=2QkJ·mol-1 |
| C.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=-4Q kJ·mol-1 |
| D.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=Q kJ·mol-1 |
在2L的密闭容器中发生下面反应:A(g)+2B(g)=3C(g),经过3min后A的物质由10mol变为7mol,则下面表示的反应速率正确的是
| A.vA=1mol·L-1·min-1 | B.vB=1mol·L-1·min-1 |
| C.vC=2mol·L-1·min-1 | D.vB=2mol·L-1·min-1 |