下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。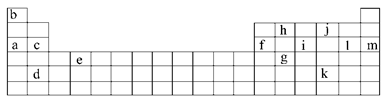
(1)下列__________(填写编号)组元素的单质具有良好导电性。
①a、c、h ②b、g、k ③c、h、i ④d、e、f
(2)下表是一些气态原子失去核外不同电子所需的能量,(即电离能,单位为kJ·mol-1):
| 电离能 |
锂 |
X |
Y |
| I2 |
519 |
502 |
580 |
| I2 |
7 296 |
4 570 |
1 820 |
| I3 |
11 799 |
6 920 |
2 750 |
| I4 |
|
9 550 |
11 600 |
①为什么锂原子的第二电离能远远大于第一电离能
________________________________________________________________________。
②表中X可能为以上13种元素中的__________(填写字母)元素。用元素符号表示X和j形成化合物的化学式_________________________________________________________。
③Y是周期表中__________族元素。
④以上13种元素中,_______(填写字母)元素原子失去核外第一个电子需要的能量最多。
1)在Fe3O4 +4CO 3Fe+4CO2的反应中,是氧化剂,是还原剂,元素被氧化,元素被还原。
3Fe+4CO2的反应中,是氧化剂,是还原剂,元素被氧化,元素被还原。
2)配平下列化学方程式并用单线桥法分析下列氧化还原反应中电子转移的方向和数目,
Cu +HNO3(浓)— Cu(NO3)2 + NO2↑ +H2O
浓硝酸表现出来的性质是_______________(填写编号)。
①还原性 ②酸性 ③氧化性
按要求写出对应的方程式:
1)H++HCO3- = H2O+CO2↑(写出符合该离子反应的两种不同类型的化学方程式)
;。
2)KAl(SO4)2在水溶液中的电离方程式:。
3)铝片与硝酸汞溶液反应的离子方程式: 。
。
下列物质:①Cu② CO2③ H2SO3 ④ H2O ⑤液态HCl ⑥ H2SO4 ⑦ Ba(OH)2⑧ NaCl⑨蔗糖⑩NaOH溶液。
属于电解质的是,属于非电解质的是,能导电的是。(填序号,必须填全,否则不得分)
单质硼有无定形和晶体两种。已知晶体硼的基本结构单元是由硼原子组成的正二十面体(如图所示),
其中含有二十个等边三角形和一定数目的顶角,每个顶角上各有一个硼原子。通过观察图形及计算确定:
①该基本结构单元是由________个硼原子构成的;键角是_________;所含B-B键的数目是_________。
②若将晶体硼结构单元中的每一个顶角均削去,余下的部分和C60晶体的结构相同,据此确定:C60是由_______个正六边形和_______个正五边形构成;一个C60中含有个碳碳单键,有个碳碳双键。
(1)铁及铁的化合物在生产、生活中有着重要的用途。
①、聚合硫酸铁(简称PFS)[Fe (OH)n(SO4)(3-n) / 2 ]m(m是聚合度),常用于在水体中形成絮状物,以吸附重金属离子。则其中铁元素的价态为__________,SO42-的空间构型为。
②、六氰合铁酸钾K3[Fe(CN)6]可用于检验Fe2+,出现特殊的蓝色沉淀。CN-中碳原子的杂化方式为__________,写出与CN一互为等电子体的一种离子的化学式_______,其电子式为________。
③三氯化铁在常温下为固体,熔点304℃,沸点316℃,300℃以上可升华,易溶于水,也易溶于乙醚,丙酮等有机溶剂。据此推断三氯化铁晶体为__________晶体。
④普鲁士蓝是一种配合物,可用作染料,它的结构单元如右图所示,普鲁士蓝中n(CN一):n(K+):n(Fe3+):n(Fe2+) = ____________。
(2)水和氨有相似之处,如:H2O+H+=H3O+ 、NH3+H+=NH4+。
①NH4+的键角__________H3O+的键角(填“大于”或“小于”)。
②冰和固态氨的晶胞都不属于分子最密堆积,原因是__________________。