决定化学反应速率的主要因素是( )
① 温度 ② 压强 ③ 催化剂 ④ 浓度 ⑤ 反应物本身的性质
A ①②③④⑤ B ⑤ C ①④ D ①②③④
25℃时,某物质的溶液中,由水电离出的c(H+)=1×10-5mol·L-1,下列说法一定正确的是
| A.该溶液的溶质是碱 | B.该溶液显碱性 |
| C.该溶液的溶质是酸 | D.该溶液的溶质是盐 |
在体积相同,物质的量浓度相等的HCl溶液和CH3COOH溶液中分别加入足量Mg粉,产生H2的体积(同温同压下测定)的变化图示正确的是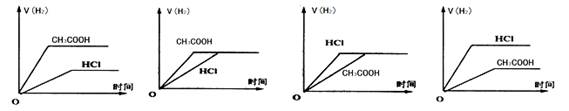
A. B. C.D.
下列表述与示意图相符的是
| A.正反应为吸热反应 |
| B.升高温度,有利于反应向正方向进行 |
| C.A点时,反应向逆反应方向移动 |
| D.K正与K逆的关系是:K正=1/K逆 |
下列说法正确的是
| A.氢气是一种高效而没有污染的一级能源 |
| B.太阳能、氢能、风能、海洋能、地热能和生物质能等都是新能源 |
| C.CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的ΔH<0 |
| D.水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应 |
反应CO(g) +H2O(g)  H2(g) +CO2(g) ΔH<0,改变其中一种条件,能加快反应速率且反应放出的热量不变的是
H2(g) +CO2(g) ΔH<0,改变其中一种条件,能加快反应速率且反应放出的热量不变的是
| A.升高温度 | B.减小压强 | C.加入CO | D.加入催化剂 |