向四只盛有一定量NaOH溶液的烧杯中通入不同量的CO2气体后,可以得到不同的成分组合,其中混合组分的物质的量为1:1 请选择下列分析都正确的组合是:
| |
溶液组成主要成分 |
溶液中离子浓度关系 |
| A |
NaHCO3、Na2CO3 |
c(CO32-) < c(HCO3-) |
| B |
NaOH 、 Na2CO3 |
c(OH-)<c(CO32-) |
| C |
Na2CO3 |
c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| D |
NaHCO3、NaOH |
c(Na+) = c(HCO3-) |
下列有关离子方程式书写正确的
| A.向含1molFeI2溶液中通入标准状况下22.4LCl22Fe2+ + 2I- + 2Cl2 = 2Fe3+ + I2 + 2Cl- |
| B.向醋酸钠溶液中通入过量CO2 CH3COO- + CO2 + H2O →HCO3- +2 CH3COOH |
| C.向NaHSO4溶液中滴加Ba(OH)2溶液至中性2H++ SO42- + Ba2+ + 2OH- = BaSO4↓ + 2H2O |
| D.以金属银为阳极电解饱和硫酸铜溶液 Cu2+ + 2H2O=" 2Cu" + O2↑+ 4H+ |
下表中所列的都是烷烃,它们的一卤取代物均只有一种,分析下表中各项的排布规律,按此规律排布第6项应为:
| 1 |
2 |
3 |
4 |
5 |
6 |
…… |
| …… |
C2H6 |
C5H12 |
C8H18 |
…… |
…… |
A.C14H30 B.C17H36 C.C20H42 D.C26H54
已知温度T时,水的离子积常数为KW,该温度下将V1mLa mol•L-1的一元酸HA与V2mLb mol•L-1的一元碱BOH充分混合,下列判断一定正确的是
A.若V1a=V2b,稀释此混合溶液时,溶液中各离子浓度一定都发生变化
B.若pH(HA)+ pH(BOH)=14,则V1=V2时,酸碱恰好完全中和
C.此混合液中:2c(H+)+c(B+)≤c(OH-)+c(A-)
D.若混合溶液中c(OH-)=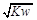 mol•L-1,则此溶液一定呈中性
mol•L-1,则此溶液一定呈中性
用NA表示阿伏加德罗常数的值,下列叙述正确的是
| A.24g NaH中阴离子所含电子总数为NA |
| B.标准状况下,22.4 L苯中含有C—H键数目为6NA |
| C.在碳酸钠溶液中,若c(CO32-)="1" mol•L-1,则c(Na+)="2" mol•L-1 |
| D.通过MnO2催化使H2O2分解,产生32gO2时转移电子数为2NA |
下列说法正确的是
| A.目前使用的燃料液化石油气,其主要成分均属于烃 |
| B.食用白糖的主要成分是蔗糖,小苏打的主要成分是碳酸钠 |
| C.明矾在自来水的生产过程中,常用于杀菌消毒 |
| D.饮用酒在窖藏过程中主要发生酯化反应,酯化反应不属于取代反应 |