元素性质呈周期性变化的决定因素是( )
| A.元素的原子半径大小呈周期性变化 | B.元素相对原子质量依次递增 |
| C.元素原子的核外电子排布呈周期性变化 | D.元素的主要化合价呈周期性变化 |
检验某溶液中是否含有 K+、Fe3+、Cl-、Mg2+、I-、CO32-、SO42-,限用的试剂有:盐酸、硫酸、硝酸银溶液、硝酸钡溶液。设计如下实验步骤,并记录相关现象。下列叙述不正确的是
| A.试剂①为硝酸钡 |
| B.试剂②一定为盐酸 |
| C.该溶液中一定有 I-、CO32-、SO42-、K+ |
| D.通过在黄色溶液中加入硝酸银溶液可以检验原溶液中是否存在Cl- |
下列实验操作中,装置选择不合理的是
| A |
B |
C |
D |
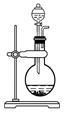 |
 |
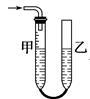 |
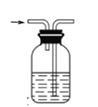 洗气瓶 |
| 快速制备少量NH3 |
H2的尾气处理 |
测量NO的体积 |
除去乙烯中的SO2 |
在标准状况下,1体积水溶解224体积氨气,所得溶液密度为0.9g/cm3,这种氨水的物质的量浓度和质量分数分别为
| A.7.69mol/L 14.5% | B.8.15 mol/L 15.4% |
| C.7.69 mol/L 15.4% | D.8.17 mol/L 14.5% |
铬是人体必需的微量元素,它与脂类代谢有密切联系,能增强人体内胆固醇的分解和排泄,但铬过量会引起污染,危害人类健康。不同价态的铬毒性不同,三价铬对人体几乎无毒,六价铬的毒性为三价铬的100倍。下列叙述错误的是
| A.在反应Cr2O72—+I一+H+→Cr3++I2 +H2O中,氧化产物与还原产物的物质的量之比为3:2 |
| B.一般情况下污水中的Cr3+在溶解的氧气的作用下易被氧化为Cr2O72— |
| C.K2Cr2O7可以氧化乙醇,该反应可用于检查酒后驾驶 |
| D.维生素C具有还原性,发生铬中毒时,可服用维生素C缓解毒性 |
某学生鉴定甲盐溶液的流程如图所示,下列说法正确的是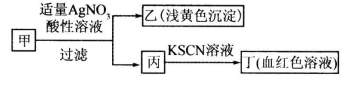
| A.如果甲中含有S2-,则乙是硫磺沉淀 |
| B.如果乙是AgCl沉淀,那么甲是FeCl3 |
| C.丙中肯定含有Fe3+,所以甲是FeBr2 |
| D.甲中含有铁元素,可能显示+2或者+3价 |