下列关于化学反应速率说法正确的是
| A.某化学反应速率快,则该反应就不会有平衡存在 |
| B.根据化学反应速率的大小可以知道化学反应进行的快慢 |
| C.若某化学反应的反应速率为0.5mol/(L·s), 就是指在该时间内反应物和生成的浓度变化都为0.5mol/(L·s) |
| D.对任何化学反应来说,反应速率越大,化学现象越明显 |
从海水中提取溴有如下反应:5NaBr+NaBrO3+3H2SO4=3Br2+Na2SO4+3H2O,与该反应在氧化还原反应原理上最相似的是()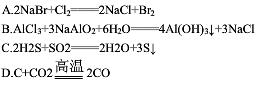
下列说法错误的是()。
| A.含氧化合物不一定是氧化物 |
| B.纯净物都是由一种物质组成的 |
| C.由一种元素组成的纯净物不一定是单质 |
| D.质子数相同的微粒不一定属于同种元素 |
下列物质中,能导电的且属于电解质的是
| A.铜 | B.食盐水 | C.酒精 | D.熔融的氯化钾 |
不能用离子方程式:CO32-+2H+ CO2↑+H2O来表示的是( )
CO2↑+H2O来表示的是( )
| A.碳酸钡与盐酸反应 |
| B.碳酸钾溶液与稀硫酸反应 |
| C.苏打溶液与稀硝酸反应 |
| D.小苏打溶液与稀硫酸反应 |
下列措施不符合节能减排的是()
| A. | 大力发展火力发电,解决广东电力紧张问题 |
| B. | 在屋顶安装太阳能热水器为居民提供生活用热水 |
| C. | 用石灰对煤燃烧后形成的烟气脱硫,并回收石膏 |
| D. | 用杂草、生活垃圾等有机废弃物在沼气池中发酵产生沼气,作家庭燃气 |