星期天回来后,小丽带着快乐的心情返回学校。当她来到实验室时,意外地发现实验桌上有瓶敞口放置已久的NaOH溶液,由此,激发了她的探究欲望。
【提出问题】这瓶NaOH溶液一定变质了,其变质程度如何呢?
【提出猜想】小丽的猜想:NaOH溶液全部变质。按照小丽的猜想,溶液中除了水,含有的物质是 。你的新猜想是,溶液中除了水,含有的物质是 。
【实验探究】小丽设计如下实验来验证自己的猜想,请根据表中内容填写小丽实验时的现象
| 实验步骤 |
现象 |
结论 |
| 取少量NaOH溶液样品于试管中,先滴加足量的CaCl2溶液,然后再滴加酚酞试液。 |
|
NaOH溶液完全变质 |
假设你的猜想正确,并按小丽的实验方案进行实验,则你观察到的实验现象__________________ _。
【实验反思】⑴下列物质①BaCl2溶液、②Ca(NO3)2溶液、③Ca(OH) 2溶液、④Ba(OH)2溶液,不能替代小丽实验中CaCl2溶液的是________(填序号)。
⑵小丽第二次滴加的试剂除用指示剂外,还可以用__________替代。
【拓展应用】保存NaOH溶液的方法是 。
某实验小组的同学用氢氧化钙溶液和盐酸进行酸碱中和反应的实验时,向烧杯中的氢氧化钙溶液加入稀盐酸一会后,发现忘记了滴加指示剂.因此,他们停止滴加稀盐酸,并对烧杯内溶液中的溶质成分进行探究.Ⅰ、写出该中和反应的化学方程式: .
Ⅱ、探究烧杯内溶液中溶质的成分.
【提出问题】该烧杯内溶液中的溶质是什么?
【猜想】猜想一:可能是CaCl2和Ca(OH)2;猜想二:可能只有CaCl2;猜想三: .
【查阅资料】氯化钙溶液呈中性.
【进行实验】实验步骤:取少量烧杯内溶液于试管中,滴入几滴酚酞溶液,振荡
实验现象: 结论:猜想一不正确
实验步骤:实验步骤取少量烧杯内溶液于另一支试管中,逐滴加入碳酸钠溶液至过量
实验现象: 结论:猜想二不正确,猜想三正确.
测定空气中氧气的含量,小华同学打算设计如下方案:选用实际容积为40mL的试管作为反应容器,将过量的白磷放入试管,用橡皮塞塞紧试管,通过导管与实际容积为60mL且润滑性很好的针筒注射器组成如下图的实验装置.假设此实验能够按照小华的设想正常进行,且白磷所占体积与导管内的气体体积忽略不计,请回答下列问题:
(1)实验前,如何检查装置的气密性: ;
(2)若先夹紧弹簧夹,用酒精灯加热白磷,燃烧结束,等到试管冷却后再松开弹簧夹.可观察到的现象为: ;
(3)若不使用弹簧夹,用酒精灯加热白磷,充分反应直至燃烧结束,试管冷却.可观察到的现象为 ;
(4)若按小华的设想进行实验,实际可能遇到诸多问题而发生危险,造成实验失败.例如: .
小李学习了二氧化碳知识后,进行了二氧化碳气体在水中溶解性的探究,其实验步骤及装置如下.
①用大号针筒抽取200毫升二氧化碳气体.
②试剂瓶中加入200毫升水,塞紧双孔橡皮塞.
③连接大号针筒和试剂瓶,缓慢推动活塞,将二氧化碳注入水中.
(1)推动注射器活塞时尽量缓慢,其目的是 .
(2)当向水中注入CO2气体体积达到120毫升时,红色油柱开始向上移动.实验表明在该条件下,1体积水中能溶解 体积的二氧化碳.
小思同学在实验室用大理石和稀盐酸反应制取二氧化碳完毕后,对废液中溶质的成分产生了兴趣.请你一同参与探究并回答下列问题:
【提出问题】废液中的溶质是什么物质?
【作出猜想】小思同学认为废液中溶质只有氯化钙.
你认为还可能有的溶质是 (填化学式).
【查阅资料】氯化钙溶液呈中性.
【实验与结论】(1)小思同学取少量废液与试管中,滴入几滴无色酚酞试液后,酚酞不变色.于是小思同学认为自己的猜想是正确的.
(2)你认为小思同学的实验不能证明他的猜想,理由是 .
(3)如果要证明你的猜想是正确的,你选择的试剂是 .
A 石蕊 B 酚酞 C Na2CO3 D NaOH
【拓展与应用】(1)实验证明你的猜想是正确的.要想处理废液只得到氯化钙溶液,应向废液中加足量或过量的( )
A.Na2CO3B.CaCO3
(2)通过以上探究,如果该废液未经处理直接倒入下水道,可能造成的危害 (写一条).
【交流与反思】在分析化学反应后所得物质的成分时,除了考虑生成物外,还需要考虑反应物是否剩余(环境污染问题).
天然气的主要成分是甲烷,某化学兴趣小组的同学对甲烷燃烧的产物进行了探究。
【提出问题】甲烷燃烧后生成了哪些物质?
【查阅资料】含碳元素的物质完全燃烧生成CO2,不完全燃烧生成CO;无水CuSO4遇水变蓝。
【猜想与假设】甲同学:CO2、H2O乙同学:CO、H2O
丙同学:NH3、CO2、H2O丁同学:CO2、CO、H2O
你认为 同学的猜想肯定是错误的,理由是 。
【实验探究】为了验证上述几位同学的猜想与假设,将甲烷在一定量的O2中燃烧的产物依次通过下列装置: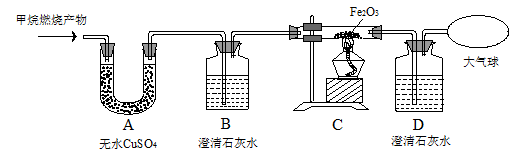
(1)A、B装置的顺序能否颠倒? (填“能”或“否”)。
(2)甲烷在一定量的O2中燃烧用的是纯净O2而不用空气的原因是 。
(3)实验中观察到装置A中无水CuSO4变蓝,B、D中澄清石灰水变浑浊,C中红色粉末变成黑色,由此推断 同学猜想成立。
(4)请写出B中澄清石灰水变浑浊,C中红色粉末变成黑色的化学方程式:
、 。
【反思与交流】为避免有毒的CO污染环境,所以含碳元素的物质燃烧必须满足的条件是
。